1、选择题 向-定量的Fe、FeO、Fe2O3的混合物中加入150mL?4 mol?L-1的稀硝酸,恰好使混合物完全溶解,放出2.24L?NO(标准状况),往所得溶液中加入KSCN溶液,溶液不呈血红色.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
A.O.21?mol
B.0.25?mol
C.0.3?mol
D.0.35?mol
参考答案:B
本题解析:分析:混合物与硝酸反应时恰好使混合物完全溶解,且所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为硝酸亚铁,由铁元素守恒可知,足量的氢气在加热下还原相同质量的混合物,得到铁的物质的量与硝酸亚铁中的铁的物质的量相同,根据硝酸的物质的量和生成NO的物质的量,求出溶液中硝酸亚铁的物质的量.
解答:因一定量的Fe、FeO、Fe3O4和Fe2O3的混合物中加入150mL?4mol/L的稀硝酸,恰好使混合物完全溶解,所得溶液中加入KSCN溶液,无血红色出现,则溶液中的溶质为Fe(NO3)2,
2.24L?NO(标准状况)的物质的量为 =0.1mol,
=0.1mol,
根据氮元素守恒,硝酸亚铁中的硝酸根离子的物质的量为0.15L×4mol/L-0.1mol=0.5mol,
所以硝酸亚铁的物质的量为0.5mol× =0.25mol,
=0.25mol,
由铁元素守恒可知,得到铁的物质的量为n(Fe)=0.25mol.
故选B.
点评:本题考查混合物的有关计算,关键是根据现象判断反应产物,利用原子守恒的方法来计算,难度中等.
本题难度:一般
2、选择题 下列表示溶液中发生反应的化学方程式错误的是
A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑
B.KMnO4+HCOOK+KOH=2K2MnO4+CO2↑+H2O
C.MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
D.K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O
参考答案:B
本题解析:分析:根据所学元素化合物的知识及氧化还原反应的基本规律,并且具有对简单氧化还原反应运用化合价的升降配平的技能等来解答此题;
解答:A、因铝既能与强酸反应又能与强碱反应,则铝与氢氧化钠反应生成偏铝酸钠和氢气,遵循质量守恒定律及氧化还原反应中电子守恒,故A对;
B、由化学方程式要遵循质量守恒定律,B项没配平;或应知在碱性条件下,不可能产生CO2气体,而应是CO32-,故B错;
C、实验室制取氯气的反应原理可知,二氧化锰与浓盐酸反应制取氢气,遵循质量守恒定律及氧化还原反应中电子守恒,故C对;
D、根据常见氧化剂、还原剂以及转化规律,D中发生氧化还原反应,遵循质量守恒定律及氧化还原反应中电子守恒,故D对;
故选:B.
点评:本题考查了化学方程式的问题,实则为元素化合物的知识以及氧化还原反应等知识点,本考点为高中化学的主干知识,为必考考点,但也是难点;学习过程中应重视元素化合物知识及氧化还原反应的基本规律.
本题难度:困难
3、选择题 一定质量的铜、铝混合物与一定体积硝酸溶液恰好完全反应,得硝酸盐溶液和NO2、N2O4、NO的混合气体,这些气体与标准状况下3.36L氧气混合后通入水中,所有气体恰好完全被水吸收生成硝酸.若向所得硝酸盐溶液中加入4mol/LNaOH溶液至沉淀最多停止加入,将所产生沉淀取出,余下溶液加水稀释至600ml,此时所得溶液的物质的量浓度为
A.1mol/L
B.0.5mol/L
C.1.2mol/L
D.2mol/L
参考答案:A
本题解析:分析:金属失去的电子等于氧气与混合气体反应生成硝酸获得的电子,向所得硝酸盐溶液中加入4mol/LNaOH溶液至沉淀最多停止加入,此时溶液为硝酸钠溶液.根据硝酸根守恒可知,钠离子物质的量等于金属失去的电子的物质的量.据此计算钠离子的物质的量,进而计算溶液的浓度.
解答:标准状况下3.36L氧气的物质的量为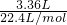 =0.15mol,所以氧气获得电子的物质的量为0.15mol×4=0.6mol.
=0.15mol,所以氧气获得电子的物质的量为0.15mol×4=0.6mol.
金属失去的电子等于氧气与混合气体反应生成硝酸获得的电子为0.6mol.
向所得硝酸盐溶液中加入4mol/LNaOH溶液至沉淀最多停止加入,此时溶液为硝酸钠溶液.根据硝酸根守恒可知,钠离子物质的量等于金属失去的电子的物质的量为0.6mol.所以硝酸钠的物质的量为0.6mol.
稀释至600ml,此时所得溶液的物质的量浓度为 =1mol/L.
=1mol/L.
故选:A.
点评:考查混合物计算、氧化还原反应计算等,难度较大,利用常规方无法解答,是守恒思想在混合计算典型利用,判断金属失去的电子等于氧气获得的电子是关键.
本题难度:简单
4、选择题 两种气态烃的混合气体共1mol,在空气中燃烧得到1.5molCO2和2molH2O。关于该混合气体的说法正确的是
A.一定含甲烷,但不含乙烯
B.一定含乙烷,不含甲烷
C.一定是甲烷和乙烯的混合气体
D.一定含有甲烷,不含乙烷
参考答案:D
本题解析:根据原子守恒可知,混合气的平均分子组成是C1.5H4,因为烃中只有甲烷含有1个碳原子,所以混合气中一定含有甲烷。甲烷分子有4个氢原子,根据平均值原理可知,另一种分子中的碳原子一定大于1,氢原子一定是4,所以可以是乙烯,丙炔等。所以答案是
本题难度:简单
5、选择题 下列有机物中可能含有酯基的是
A.CH2O2
B.C2H4O
C.C3H6O3
D.C4H10O4
参考答案:C
本题解析:酯基的结构简式为-COO-,所以分子中要含有酯基,至少含有2个氧原子,B不正确。A是甲酸,不正确。D中含有4个碳原子和10个氢原子,因此碳原子全部是饱和碳原子,不可能含有酯基。根据C的分子式可知,其结构简式可以是HOCH2COOCH3,所以正确的答案是C。
本题难度:一般