1、选择题 物质的量浓度、体积都相同的NaF和NaCN溶液中,离子总数的关系正确的是(已知HF比HCN易电离)
A.NaF=NaCN
B.NaF>NaCN
C.NaF<NaCN
D.无法确定
参考答案:B
本题解析:两溶液中离子数目的差别在于水电离出来的H+的不同,由于HCN比HF更难电离,故CN-的水解程度比F-的大,NaCN溶液中OH-离子浓度要大些,反过来溶液中由水电离出来的H+离子浓度小。
本题难度:一般
2、选择题 在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质的固体的是(?)
A.AlCl3
B.NaHCO3
C.MgSO4
D.KMnO4
参考答案:C
本题解析:盐溶液蒸干后得到的物质与多种因素有关,必须综合考虑。通过水解产生的酸是否易挥发,溶液是否易分解,是否易发生氧化还原反应等几个方面综合分析。AlCl3水解产生的HCl挥发,使Al3++3H2O 3H++Al(OH)3向右移动,致使生成Al(OH)3沉淀,它被灼烧生成Al2O3。NaHCO3、KMnO4受热后分解得到Na2CO3、K2MnO4
3H++Al(OH)3向右移动,致使生成Al(OH)3沉淀,它被灼烧生成Al2O3。NaHCO3、KMnO4受热后分解得到Na2CO3、K2MnO4
和MnO2,只有MgSO4蒸干后得到原物质
本题难度:一般
3、选择题 在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O?HCO3-+OH-下列说法正确的是( )
A.稀释溶液,水解平衡常数增大
B.通入?CO2,平衡朝正反应方向移动
C.升高温度,
减小
D.加入?NaOH固体,溶液?pH减小
参考答案:A、平衡常数仅与温度有关,温度不变,则稀释时平衡常数是不变的,故A错误;
B、CO2通入水中,生成H2CO3,可以与OH-反应,平衡正向移动,故B正确;
C、因水解是吸热的,则升温可以促进水解,平衡正向移动,c(HCO3-)c(CO32-)是增大的,故C错误;
D、加入NaOH固体,碱性肯定增强,pH增大,故D错误;
故选B.
本题解析:
本题难度:简单
4、选择题 在一定浓度的FeCl3溶液中,存在如下水解平衡:Fe3++3H2O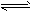 Fe(OH)3+3H+,在此溶液中滴入饱和的FeCl3溶液,下列哪个变化的说法正确
Fe(OH)3+3H+,在此溶液中滴入饱和的FeCl3溶液,下列哪个变化的说法正确
[? ]
A.水解平衡向正反应方向移动
B.水解平衡向逆反应方向移动
C.溶液中H+浓度增大
D.Fe3+的水解程度增大
参考答案:AC
本题解析:
本题难度:一般
5、选择题 [双选题]为了配制NH 与Cl-浓度比为1∶1的溶液,可在NH4Cl溶液中加入( )
与Cl-浓度比为1∶1的溶液,可在NH4Cl溶液中加入( )
A.适量的HCl
B.通适量氨气
C.适量的氨水
D.适量的NaOH
参考答案:BC
本题解析:NH4Cl溶液中c(NH )<c(Cl-),HCl虽能抑制NH
)<c(Cl-),HCl虽能抑制NH 水解,但因加入了Cl-,不符合题意;NaOH与NH
水解,但因加入了Cl-,不符合题意;NaOH与NH 反应使c(NH
反应使c(NH )更小,不符合题意;通入适量NH3或加入适量的氨水使溶液中NH
)更小,不符合题意;通入适量NH3或加入适量的氨水使溶液中NH 的浓度提高,符合题意。
的浓度提高,符合题意。
本题难度:一般