1、选择题 常温下,下列有关酸HA的叙述中,不能说明HA是弱酸的是( )
①取0.1mol/L的HA溶液,其溶液的pH为2
②测0.01mol/L的NaA溶液,其溶液的pH大于7
③用HA溶液做导电性实验,灯泡发光很暗
④等体积pH=4的盐酸和HA稀释到pH=5,HA加水量多
⑤相同体积,相同pH的盐酸和HA分别和足量锌反应,盐酸产生的氢气的量少.
⑥将pH=3的HA和pH=11的NaOH溶液等体积混合,溶液呈酸性,则HA为弱酸
⑦在0.1mol/L的NaA溶液中,其中c(Na+)>c(A-)
⑧该酸可以与碳酸钠反应,放出CO2气体.
A.③⑧
B.③④⑥
C.②④⑦⑧
D.②③⑤⑧
参考答案:①取0.1mol/L的HA溶液,其溶液的pH为2,则HA不完全电离,能说明HA是弱酸,故不选;
②测0.01mol/L的NaA溶液,其溶液的pH大于7,说明NaA是强碱弱酸盐,所以能说明是弱酸,故不选;
③用HA溶液做导电性实验,灯泡发光很暗,只能说明溶液中氢离子浓度较小,不能说明该酸的电离程度,所以不能说明该酸是弱酸,故选;
④等体积pH=4的盐酸和HA稀释到pH=5,HA加水量多,则HA在水溶液里不完全电离,所以说明HA是弱酸,故不选;
⑤相同体积,相同pH的盐酸和HA分别和足量锌反应,盐酸产生的氢气的量少,则盐酸的物质的量小于HA,所以说明HA是弱酸,故不选.
⑥将pH=3的HA和pH=11的NaOH溶液等体积混合,溶液呈酸性,酸过量,则说明HA不完全电离,所以HA为弱酸,故不选;
⑦在0.1mol/L的NaA溶液中,其中c(Na+)>c(A-),c(H+)<c(OH-),溶液呈碱性,则NaA是强碱弱酸盐,所以说明该酸是弱酸,故不选;
⑧该酸可以与碳酸钠反应,放出CO2气体,只能说明该酸的酸性比碳酸强,不能说明该酸是弱酸,故选;
故选A.
本题解析:
本题难度:一般
2、选择题 依据右图分析,下列叙述不正确的是
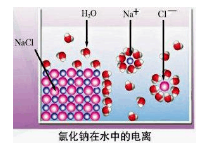
A.氯化钠是由钠离子和氯离子构成的
B.氯化钠的电离方程式为:NaCl =Na+ + Cl—
C.氯化钠的电离过程需要通电才能完成
D.氯化钠在水中形成能自由移动的水合钠离子和水合氯离子
参考答案:C
本题解析:氯化钠是离子化合物,是由离子构成的,A正确;氯化钠是完全电离的,所以选项B正确;电离不需要通电,是在水分子的作用下发生的电离,形成能自由移动的水合钠离子和水合氯离子,C不正确,D正确,答案选C。
点评:该题是高考中的常见题型和考点,属于基础性试题的考查,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
3、选择题 少量二氧化碳通入NaCN溶液中,发生如下反应:CO2 + H2O + CN- =HCO3- + HCN。以下说法正确的是(温度均为25℃)
A.电离常数:K(HCN) <Ka2 (H2CO3)
B.浓度均为0.1mol·L-1的NaCN和NaHCO3溶液的pH:NaCN <NaHCO3
C.浓度均为0.1mol·L-1的NaCN和Na2CO3溶液中,阴离子总浓度相等
D.pH均为10的 Na2CO3溶液、NaCN溶液中,水电离产生的c(OH-)相等
参考答案:D
本题解析:根据强酸制取弱酸的反应原理。少量二氧化碳通入NaCN溶液中,发生如下反应:CO2 + H2O + CN- =HCO3- + HCN。则酸性H2CO3>HCN> HCO3-。A.在相同的温度下电离平衡常数就越大,溶液的酸性越强。电离常数:K(HCN) > Ka2 (H2CO3).错误。B.对于弱酸来说,酸性越强,其水解的程度就越小。由于酸性:H2CO3>HCN。所以浓度均为0.1mol·L-1的NaCN和NaHCO3溶液的pH:NaCN > NaHCO3。错误。C.在溶液中会发生水解反应。H2O + CN- HCN+OH-.CO32- +H2O
HCN+OH-.CO32- +H2O HCO3-+OH-;HCO3-+H2O
HCO3-+OH-;HCO3-+H2O H2CO3+OH-由于CO32-水解的程度大,产生的都是阴离子,而CN-水解的程度小。水解消耗的阴离子与产生的阴离子数目相等。所以阴离子总浓度Na2CO3溶液大。错误。D.Na2CO3和NaCN都是盐,水解使溶液显碱性。若溶液的pH相等,则水电离产生的c(OH-)相等。正确。
H2CO3+OH-由于CO32-水解的程度大,产生的都是阴离子,而CN-水解的程度小。水解消耗的阴离子与产生的阴离子数目相等。所以阴离子总浓度Na2CO3溶液大。错误。D.Na2CO3和NaCN都是盐,水解使溶液显碱性。若溶液的pH相等,则水电离产生的c(OH-)相等。正确。
本题难度:一般
4、选择题 已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH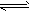 CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中
c(H+)/c(CH3COOH)值增大,可以采取的措施是
[? ]
A.加少量烧碱溶液
B.降低温度
C.加少量冰醋酸
D.加水
参考答案:D
本题解析:
本题难度:一般
5、选择题 在稀氨水溶液中存在如下平衡体系:NH3·H2O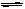 NH4++OH-,当增大溶液的pH时,c(NH4+)会(?)
NH4++OH-,当增大溶液的pH时,c(NH4+)会(?)
A.可能增大也可能减小
B.增大
C.减小
D.无变化
参考答案:A
本题解析:要提高pH,一是可以再加入氨、二是加入其它碱性较强的物质,此时电离被抑制,所以NH4+的浓度可以增大也可是减小,答案选A。
本题难度:一般