1、选择题 下列各溶液中,微粒的物质的量浓度关系表述正确的是(?)
A.将pH=5的硫酸溶液稀释1000倍后,溶液中的SO42-与H+浓度的比值约为1 :20
B.0.1 mol/L NaHCO3溶液中:c(Na+)=c(HCO3-)+ c(H2CO3) +2 c(CO32-)
C.将0.2 mol/L NaA溶液和0.1 mol/L盐酸溶液等体积混合所得溶液显碱性且有:
c(Na+)+ c(H+)=c(A-) +c(Cl-)
D.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,由水电离出来的c(H+)相等
参考答案:A
本题解析:B.0.1 mol/L NaHCO3溶液中,由物料守恒可知,c(Na+)=(HCO3-)+c(H2CO3)+c(CO32-),故B错误;
C.将0.2mol/LNaA溶液和0.1 mol?L-1盐酸溶液等体积混合所得碱性溶液中,溶液不显电性,则由电荷守恒可知c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-),故C错误;
D.碱抑制水的电离,能水解的盐可促进水的电离,则pH=l2的Ba(OH)2溶液水电离的c(H+)=10-12mol/L,pH=12的Na2CO3溶液中水电离的c(H+)=10-2mol/L,故D错误;
故选A。
点评:本题考查离子浓度大小的比较,熟悉溶液中的电荷守恒、物料守恒、盐的水解及电离等知识即可解答,题目难度中等,选项BC为易错点。
本题难度:简单
2、选择题 常温下,对下列四种溶液的叙述正确的是
?
| ①
| ②
| ③
| ④
|
pH
| 10
| 10
| 4
| 4
|
溶液
| 氨水
| 氢氧化钠溶液
| 醋酸溶液
| 盐酸
|
A.四种溶液分别加水稀释10倍,pH变化最大的是①和④?
B.②、④两溶液相比,两者的kw相同
C.①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小
D.①、④两溶液按一定体积比混合,所得溶液中离子浓度顺序一定为: c(NH4+)>c(Cl-)>c(H+)> c(OH-)
参考答案:B
本题解析:①氨水是弱碱,当溶液稀释时,未电离的电解质分子会继续电离,使c(OH-)又略有增大,pH变化较小,③醋酸是弱酸当溶液稀释时,未电离的电解质分子会继续电离,使c(OH-)又略有增大,pH变化较小,而②氢氧化钠溶液和④的HCl都是强电解质,当加水稀释时,只有溶液的稀释作用,使离子的浓度减小,所以当稀释相同倍数时pH变化较大。因此稀释相同倍数时,pH变化最大的是②和④。错误。B.kw只与温度有关,②、④在相同的温度下,所以水溶液的两溶液kw相同。正确。C.向①加入少量的醋酸铵固体,对一水合氨的电离起抑制作用,所以溶液的pH均减小;向②加入少量的醋酸铵固体,铵根离子会与OH-离子结合形成一水合氨,使c(OH-)减小,所以溶液的pH均减小;向③中加入少量的醋酸铵固体后,由于增大了醋酸根离子的浓度,醋酸的电离平衡逆向移动,醋酸的电离程度减小,所以三种溶液的pH增大。错误。D.不符合电荷守恒的规律,应该是c(NH4+)>c(Cl-)> c(OH-) >c(H+)或者c(Cl-)>c(NH4+)>c(H+)>c(OH-)。错误。
本题难度:一般
3、选择题 下列有关叙述正确的是 (?)
A.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)= c(HCO )+c(H2CO3)
)+c(H2CO3)
B.pH=4.5的柠檬汁中c(H+)是pH=6.5的番茄汁中c(H+)的100倍
C.100 ml pH=3的HA溶液、HB溶液分别与足量的锌反应,HA溶液放出的氢气较多,说明HA的酸性比HB的强
D.pH=5.5的CH3COOH与CH3COONa混合溶液中:c(Na+)> c(CH3COO-)
参考答案:B
本题解析:A、根据元素守恒规律,应有c(HClO)+c(ClO-)= c(HCO )+c(H2CO3)+ c(CO32-),错误;B、pH=4.5的柠檬汁中c(H+)=1×10-4.5mol/L,pH=6.5的番茄汁中c(H+)=1×10-6.5mol/L,前者是后者的100倍,正确;C、HA溶液、HB溶液的体积相等,氢离子浓度相等,与足量锌反应产生的氢气HA多,说明酸HA的浓度比酸HB的浓度大,酸性弱,错误;D、CH3COOH与CH3COONa混合溶液的pH=5.5,说明醋酸电离程度大于醋酸根离子水解程度,所以c(Na+)<c(CH3COO-),错误,答案选B。
)+c(H2CO3)+ c(CO32-),错误;B、pH=4.5的柠檬汁中c(H+)=1×10-4.5mol/L,pH=6.5的番茄汁中c(H+)=1×10-6.5mol/L,前者是后者的100倍,正确;C、HA溶液、HB溶液的体积相等,氢离子浓度相等,与足量锌反应产生的氢气HA多,说明酸HA的浓度比酸HB的浓度大,酸性弱,错误;D、CH3COOH与CH3COONa混合溶液的pH=5.5,说明醋酸电离程度大于醋酸根离子水解程度,所以c(Na+)<c(CH3COO-),错误,答案选B。
本题难度:一般
4、简答题 醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠、醋酸铵是其常见的盐,已知醋酸铵溶液呈中性.请回答:
(1)常温下,向1L0.1mol/L的醋酸溶液中加入0.1mol醋酸钠固体,则醋酸的电离平衡向______(填“正”或“逆”)反应方向移动,溶液中
c(CH3COO-)?c(H+)
c(CH3COOH)
|
的值______(填“增大”、“减小”或“不变”).此时测得溶液pH<7,则溶液中各离子浓度的大小顺序是______;
(2)下列说法中,正确的是______(填字母);
a.CH3COOH溶液加水稀释后,溶液中c(CH3COOH)
c(CH3COO-)c(H+)
|
的值减小
b.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
c.升高温度可以促进醋酸电离,也能够促进醋酸钠水解
(3)常温下amol/LCH3COOH稀溶液和bmol/LKOH稀溶液等体积混合,下列判断一定错误的是______.
a.若c(OH-)>c(H+),a=b
b.若c(K+)>c(CH3COO-),a>b
c.若c(OH-)=c(H+),a>b
d.若c(K+)<c(CH3COO-),a<b.
参考答案:(1)在醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加入醋酸钠,醋酸根离子浓度增大对醋酸的电离平衡逆移;Ka=c(CH3COO-)?c(H+)c(CH3COOH),Ka不随浓度的变化而变化,只受温度影响,所以溶液中c(CH3COO-)?c(H+)c(CH3COOH)的值不变;此时测得溶液pH<7,混合溶液中醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(Na+),溶液显酸性c(H+)>c(OH-),醋酸的酸性较弱,溶液中的氢离子浓度较小,所以溶液中各离子浓度的大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
故答案为:逆;不变;c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(2)a.醋酸的Ka只与温度有关,所以溶液中c(CH3COOH)c(CH3COO-)c(H+)=1Ka的值不变,故a错误;
b.CH3COONH4促进水的电离,NaCl对水的电离无影响,所以两溶液中水的电离程度不同,故b错误;
c.弱电解质的电离和盐的水解都是吸热过程,所以升高温度可以促进醋酸电离,也能够促进醋酸钠水解,故c正确;
故答案为:c;
(3)a.若c(OH-)>c(H+),溶液中的溶质可能是醋酸钾也可能是醋酸钾与氢氧化钾的混合物,所以则a≤b,故a正确;
b.若c(K+)>c(CH3COO-),根据电荷守恒得c(OH-)>c(H+),溶液显碱性,溶液中的溶质可能是醋酸钾也可能是醋酸钾与氢氧化钾的混合物,所以则a≤b,故b错误;
c.若c(OH-)=c(H+),溶液呈中性,醋酸钠溶液呈碱性,要使溶液呈中性,则酸应该稍微过量,所以a>b,故c正确;
d.若c(K+)<c(CH3COO-),根据电荷守恒知c(OH-)<c(H+),溶液呈酸性,则酸过量,所以a>b,故d错误;
故答案为:bd.
本题解析:
本题难度:简单
5、填空题 (14分)化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)  2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
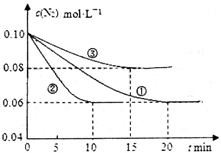
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=__________________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________、__________(填字母编号)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)="0.05" mol/L,则该反应的平衡常数K=_______________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将_____________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
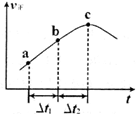
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a______b。 (填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=________________。
H2O的电离平衡常数Kb=________________。
参考答案:(14分)(1)0.008mol/(L·min)(2分);E(1分);C(1分)
(2)①5L/mol(2分) ②减小(2分),③C(2分);
(3)>(2分) 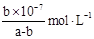 (2分)
(2分)
本题解析:(1)根据图示可知实验②从初始到平衡的过程中,该反应的平均反应速率v(N2)=(0.1mol/L-0.06mol/L)÷10min=0.004mol/(L·min),由于v(NH3):v(N2)=2:1,所以v(NH3)="2" v(N2)=0.008mol /(L·min);与实验①相比,实验②达到平衡所需要的时间短,反应速率快,而物质的平衡浓度没有变化,说明平衡没有发生移动,则所改变的实验条件是加入催化剂,选项是E;而实验③达到平衡所需要的时间短,反应速率快,而物质N2的平衡浓度比①高,说明平衡向逆反应方向移动,所改变的实验条件是升高温度,选项是C;(2)已知NO2与N2O4可以相互转化:2NO2(g)  N2O4(g)。①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,在反应开始时c(NO2)=0.20mol/L.达到平衡后,测得容器中c(N2O4)="0.05" mol/L,根据方程式中物质反应的关系可知,消耗?c(NO2)=0.10mol/L.,所以c(NO2)(ph)=0.10mol/L.则该反应的平衡常数K=
N2O4(g)。①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,在反应开始时c(NO2)=0.20mol/L.达到平衡后,测得容器中c(N2O4)="0.05" mol/L,根据方程式中物质反应的关系可知,消耗?c(NO2)=0.10mol/L.,所以c(NO2)(ph)=0.10mol/L.则该反应的平衡常数K=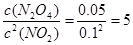 (mol/L);②已知N2O4在较高温度下难以稳定存在,易转化为NO2,说明升高温度,平衡逆向移动,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,正反应是放热反应。则升高温度上述反应的平衡常数K将减小;③A.根据图像可知正反应速率随时间的延长而升高,说明反应正向进行,反应在c点时显示的速率最大,但此时反应可能处于平衡状态,也可能未达到判断,延长不能判断反应是否处于平衡状态,错误;B.由于反应是从正反应方向开始的,所以反应物的浓度会逐渐减小,当达到平衡时达到最小值,所以反应物浓度:a点大于b点,错误;C.由于正反应是放热反应,所以Δt1=Δt2时,温度在b~c段高于a~b段,因为温度对速率的影响大于浓度的影响,所以NO2的转化率:a~b段小于 b~c段,正确。(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,若二者的物质的量相等,则反应恰好产生NH4Cl,该盐是强酸弱碱盐,水解使溶液显酸性,若反应后溶液恰好显中性,则氨水应该稍微过量,所以a>b;NH3·H2O
(mol/L);②已知N2O4在较高温度下难以稳定存在,易转化为NO2,说明升高温度,平衡逆向移动,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,正反应是放热反应。则升高温度上述反应的平衡常数K将减小;③A.根据图像可知正反应速率随时间的延长而升高,说明反应正向进行,反应在c点时显示的速率最大,但此时反应可能处于平衡状态,也可能未达到判断,延长不能判断反应是否处于平衡状态,错误;B.由于反应是从正反应方向开始的,所以反应物的浓度会逐渐减小,当达到平衡时达到最小值,所以反应物浓度:a点大于b点,错误;C.由于正反应是放热反应,所以Δt1=Δt2时,温度在b~c段高于a~b段,因为温度对速率的影响大于浓度的影响,所以NO2的转化率:a~b段小于 b~c段,正确。(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,若二者的物质的量相等,则反应恰好产生NH4Cl,该盐是强酸弱碱盐,水解使溶液显酸性,若反应后溶液恰好显中性,则氨水应该稍微过量,所以a>b;NH3·H2O NH4++OH-;当达到电离平衡时c(NH3·H2O)=(a-b)mol/L,c(OH-)=10-7mol/L,所以NH3
NH4++OH-;当达到电离平衡时c(NH3·H2O)=(a-b)mol/L,c(OH-)=10-7mol/L,所以NH3 H2O的电离平衡常数Kb=
H2O的电离平衡常数Kb=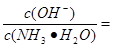
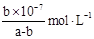 。
。
考点:考查化学反应速率的计算、、化学平衡状态的判断、影响化学平衡的因素、物质的电离平衡产生的表达式的书写的知识。
本题难度:困难