1、选择题 在下列反应中气体反应物只能作还原剂的是 (?)
A.CO2气体通入石灰水:CO2+Ca(OH)2===CaCO3↓+H2O
B.SO2气体通入氢硫酸溶液:SO2+2H2S===3S↓+2H2O
C.CO气体通入盛有灼燃CuO的试管中: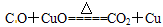
D.将氨气通入硝酸中:NH3+HNO3===NH4NO3
参考答案:C
本题解析:A错误,是非氧化还原反应。
B错误,SO2起氧化剂作用。
C正确。
D错误,D中无元素化合价,变化是非氧化还原反应。所以答案该选C。
本题难度:简单
2、选择题 下列有关化学用语表示正确的是
A.氯化铵的电子式: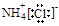
B.中子数为21的钾原子:
C.甲烷分子的球棍模型:
D.HCO3-水解的离子方程式:HCO3-+H2O H2CO3+H3O+
H2CO3+H3O+
参考答案:B
本题解析:A.铵根离子的电子式没有标出,错误;B正确;C.甲烷分子的比例模型: ,错误;D.HCO3-水解的离子方程式:HCO3-+H2O
,错误;D.HCO3-水解的离子方程式:HCO3-+H2O H2CO3+OH-,错误;
H2CO3+OH-,错误;
本题难度:一般
3、选择题 下列过程属于物理变化的是? (? )
A.由乙烯变为聚乙烯
B.蛋白质盐析
C.O2转变为O3
D.皂化反应
参考答案:B
本题解析:有新物质生成的是化学变化,没有新物质生成的是物理变化,据此可知,B是物理变化,其余选项都是化学变化,答案选B。
点评:该题是高考中的常见题型,试题基础性强,侧重对学生基础知识对巩固和训练,难度不大。该题的关键是记住物理变化和化学变化的区别,以及判断依据,有利于提高学生的学习效率。
本题难度:简单
4、简答题 将32g铜与200mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L.请回答:
(1)求混合气体中NO2和NO的体积分别是多少;
(2)待产生的气体全部释放后,向溶液中加入300mL 5mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,求原有硝酸的物质的量浓度.
参考答案:(1)32g铜的物质的量为32g64g/mol=0.5mol,11.2L混合气体的物质的量为11.2L22.4L/mol=0.5mol,
令混合气体中NO和NO2物质的量分别为xmol、ymol,
由电子转移守恒有:3x+y=0.5×2,
由二者物质的量之和:x+y=0.5
联立方程,解得x=0.25,y=0.25,
故NO的体积为0.25mol×22.4L/mol=5.6L,
NO2的体积为0.25mol×22.4L/mol=5.6L,
答:混合气体中NO2和NO的体积分别为5.6L、5.6L;
(2)向反应后溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,由钠离子守恒n(NaNO3)=n(NaOH)=0.3L×5mol/L=1.5mol,根据氮原子守恒可知n(HNO3)=n(NaNO3)+n(NO2+NO)=1.5mol+0.5mol=2mol,故原有硝酸的物质的量浓度为2mol0.2L=10mol/L,
答:原有硝酸的物质的量浓度为10mol/L.
本题解析:
本题难度:一般
5、选择题 科学家最近研究出一种环保,安全的储氢方法,其原理可表示为:
NaHCO3+H2 HCOONa+H2O,下列有关说法不正确的是(? )
HCOONa+H2O,下列有关说法不正确的是(? )
A.储氢、释氢过程均有能量变化
B.NaHCO3、HCOONa均含有离子键和共价键
C.储氢过程中,NaHCO3被还原
D.释氢过程中,每消耗0.1mol H2O放出2.24L的H2
参考答案:D
本题解析:A.无论是储氢还是释氢过程都有化学键的断裂和生成,短化学键吸收能量,形成化学键放出能量。因此均有能量变化。正确。B.NaHCO3、HCOONa都是离子化合物,含有离子键,在酸根离子中都含有极性共价键。因此它们均含有离子键和共价键。正确。C.储氢过程中,H2失去电子,被氧化,NaHCO3得到电子被还原。正确。D.释氢过程中,每消耗0.1mol H2O放出0.1mol的氢气。在标准状态下 其体积为2.24L.错误。
本题难度:一般