|
高中化学知识点讲解《有关氧化还原反应的计算》试题强化练习(2019年最新版)(四)
2019-05-30 04:33:11
【 大 中 小】
|
1、选择题 将9.0g铜和铁的混合物投入100 ml稀硝酸中,充分反应后得到标准状况下1.12L NO,剩余4.8g金属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下l.12L NO。若向反应后的溶液中滴入KSCN溶液,溶液不变红。则下列说法正确的是
A.第一次与100 mL稀硝酸反应后剩余4.8g金属为铜和铁
B.反应前稀硝酸的物质的量浓度无法计算
C.若向上述最后所得溶液中再加入足量的稀硝酸,还可得到标准状况下1.12L NO
D.原混合物中铜和铁的物质的量各为0.075 mol
|
参考答案:D
本题解析:两次反应后,向反应后的溶液中滴入KSCN溶液,溶液不变红,说明铁全部生成Fe3+,生成NO共0.1mol,则溶液中的溶液中溶质为Cu(NO3)2、Fe(NO3)2,则由原子守恒得:
n(Cu)×64g/mol+n(Fe)×56g/mol=9.0g
由电子守恒可得:
2×[n(Cu)+n(Fe)]=0.1mol×3
解得:n(Cu)=n(Fe)=0.075mol,故D正确。
A、因n(Fe)=0.075mol质量为4.2g,当铁完全反应时剩余4.8g全为铜。不可能为铁与铜的混合物。故A不错误。
B、由N原子守恒可知n(HNO3)=0.1mol+2×[n(Cu)+n(Fe)]=0.4mol,c(HNO3)=0.4mol/0.2L=2mol/L,故B错误。
C、再加足量稀硝酸,溶液中的Fe2+继续发生氧化还原反应放出NO,由电荷守恒1×n(Fe2+)=3×n(NO),得n(NO)=0.025mol,体积为0.56L。故C错误。
考点:了解金属与硝酸的反应,并能进行简单计算。
点评:本题考查离子晶体配位数的影响因素(几何因素、电荷因素等),晶格能对晶体性质的影响,碳酸盐热分解温度的规律等。
本题难度:一般
2、填空题 按要求写出下列反应的化学方程式
(1)铁在氯气中燃烧______.
(2)氯气水反应______.
(3)工业制取漂白粉______.
(4)实验室制取氯气______.
参考答案:(1)氯气能将金属氧化为最高价,铁在氯气中燃烧的产物是氯化铁,故答案为:2Fe+3Cl2?点燃?.?2FeCl3;
(2)氯气能溶于水,生成盐酸和次氯酸,反应方程式为:Cl2+H2O=HCl+HClO,故答案为:Cl2+H2O=HCl+HClO;
(3)工业上用氯气和熟石灰来制取漂白粉,原理是:Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)实验室中用二氧化锰和浓盐酸加热来制取氯气,原理是:MnO2+4HCl?△?.?MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl?△?.?MnCl2+Cl2↑+2H2O.
本题解析:
本题难度:一般
3、选择题 某金属的硝酸盐受热分解时,生成NO2和O2的物质的量之比是2∶1,则在分解过程中金属元素的化合价是(?)
A.升高
B.降低
C.不变
D.无法确定
参考答案:B
本题解析:根据元素化合价的变化可知,NO2是还原产物,氧气是氧化产物。生成1mol氧气转移4mol电子,而生成2molNO2转移2mol电子,所以根据电子的得失守恒可知,金属元素的化合价一定是降低的,答案选B。
本题难度:简单
4、选择题 有Fe2+、NO-3、Fe3+、NH+4、H+和H2O六种粒子,分别属于同一个氧化还原反应中的反应物和生成物。下列叙述正确的是?(?)
A.反应中NH+4被氧化
B.氧化剂与还原剂的物质的量之比为8:1
C.若有10molH+参加反应,则生成的水的物质的量为5mol
D.生成物中加入KSCN溶液后变红色
参考答案:D
本题解析:通过观察可知,亚铁离子在酸性条件下被硝酸根离子氧化为铁离子,铁离子遇KSCN溶液变为红色。反应的离子方程式为,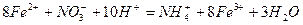 。 。
本题难度:一般
5、填空题 (3分)写出下列物质的结构式
①CH4_____________?②?NH3__________?③ Cl2_____________
参考答案:

本题解析:略
本题难度:一般
|