1、实验题 (16分)铁的单质和化合物在实验和实际生产中都有重要作用。
Ⅰ.某同学将Cl2通入FeCl2和KSCN混合溶液中,现象为:
操作
| 现象
|
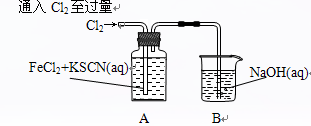
| 现象1:A中溶液变红
现象2:稍后,溶液由红色变为黄色
|
(1)B装置中反应的化学方程式____________ _ _______________ _______。
(2)A中溶液变红的原因是____________________ _ _________________________。
(3)为探究产生现象2的原因,该同学进行如下实验:
①取少量A中黄色溶液于试管加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_ _。
②取少量A中黄色溶液于试管中,加入过量KSCN溶液,最终得到血红色溶液。
实验说明,Fe3+与SCN-生成红色Fe(SCN) 3的反应 可逆反应(是或不是)。
(4)该同学根据实验猜想,SCN-可能被氯水氧化。查资料得知SCN-的电子式为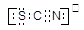 ,
,
离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H+ + CO2 ;
①上述反应中,0.5molSCN-被氧化时转移的电子总数为 个。
②若要检验产物中含有SO42-,常用的化学试剂是________(写试剂名称)。
Ⅱ.高铁电池因原料丰富、绿色环保而倍受关注。Zn-K2FeO4碱性电池的某电极的放电产物为FeOOH,该极电极为______极,电极反应式为________________ __。
2、填空题 (12分)Fe、Ca是重要的金属元素。运用所学知识,回答下列问题。
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式: ;
(2)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,该现象说明该溶液中含有的离子是 ;
②验证该溶液中含有Fe2+,正确的实验方法是 ;
A.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
B.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
C.观察溶液是否呈浅绿色
(3)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3~2.7×10-3mol·L-1。现抽取某人血样10ml。稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙CaC2O4沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0ml 5.0×10-3 mol·L-1KMnO4溶液与溶解得到的草酸恰好完全反应。据此可求此人血液中的Ca2+的浓度,并判断其血液含钙量是否正常。
(提示2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O)
①配制5.0×10-3 mol·L-1KMnO4 200mL溶液,需要称取KMnO4固体的质量是 g;
②每消耗草酸0.5mol,转移电子的物质的量为 mol;
③此人血液中的Ca2+的浓度为 mol·L-1。
3、选择题 一定条件下硝酸铵受热分解的化学方程式(未配平)为:NH4NO3=HNO3+N2+H2O,在反应中被氧化与被还原的氮原子数之比为
A.5:3
B.5:4
C.1:1
D.3:5