1、选择题 镁粉在焰火、闪光粉、鞭炮的制造中是不可少的原料。工业上制造镁粉是将镁蒸气在某气体中冷却。下列气体:①空气;②二氧化碳;③氩气;④氢气;⑤氮气中可作冷却气体的是(?)
A.①②
B.②③
C.③④
D.④⑤
参考答案:C
本题解析:镁粉在高温下可以和氧气、氮气、二氧化碳气体、氯气等反应,所以不能在这些气体中冷却。
本题难度:一般
2、选择题 将铜和镁的合金完全溶于浓HNO3溶液中,若反应中HNO3被还原产生4.48L(标准状况,下同)NO2气体和0.336 L N2O4气体,向反应后的溶液中加入足量的NaOH溶液,生成沉淀的质量为8.51g,则合金的质量为(?)
A.2.7g
B.4.6g
C.8.2g
D.无法计算
参考答案:B
本题解析:略
本题难度:一般
3、选择题 下列物质既能与盐酸反应放出气体,又能与氢氧化钠溶液反应放出气体的是
A.Al
B.Al2O3
C.Al(OH)3
D.NaHCO3
参考答案:A
本题解析:既能与盐酸反应放出气体又能与氢氧化钠溶液反应放出气体的是两性金属。Al是两性金属,所以答案选A。
点评:本题非常基础简单。
本题难度:简单
4、填空题 将一定质量的Mg和Al的混合物投入2.0 mol/L,250 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。回答下列问题:
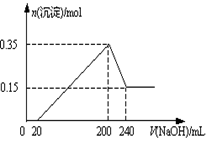
(1)由图可知加入镁的物质的量是 _____________________。
(2)当加入NaOH溶液的体积小于20mL时发生的离子反应是__________,当加入NaOH溶液的体积大于200 mL时发生的离子反应是______________。
(3)NaOH溶液的物质的量浓度为______________________。
参考答案:(1)0.15 mol?
(2)H++OH—= H2O? Al(OH)3+ OH—=AlO2— +2 H2O。
(3)5 mol/L或5.0 mol/L
本题解析:(1)因为最后的沉淀都为氢氧化镁为0.15mol,所以加入镁的物质的量为0.15mol;
(2)当氢氧化钠溶液的体积小于20mL时,中和溶液中的氢离子,因为此时并无沉淀生成,当氢氧化钠溶液的体积大于200mL后,氢氧根离子就会和氢氧化铝沉淀发生反应生成偏铝酸离子;
(3)设氢氧化钠的物质的量浓度为X,有Ymol的铝,则有:
0.15+Y/2*3+0.02X/2=2.0*0.25
0.15*2+4Y=(0.24-0.02)*X
解得:X=5? Y=0.2
本题难度:一般
5、选择题 下列实验中金属或金属氧化物可以完全溶解的是?(?)
A.1 mol铜片与含2 mol H2SO4的浓硫酸共热
B.常温下1 mol铝片投入足量的浓硫酸中
C.1 mol MnO2粉末与含2 mol H2O2的溶液共热
D.常温下1 mol铜片投入含4 mol HNO3的浓硝酸中
参考答案:D
本题解析:A错,随反应的不断进行,浓硫酸会变为稀硫酸,稀硫酸与铜不反应;B错,常温下铝在冷的浓硫酸中发生钝化;C错,二氧化锰在反应中作催化剂作用;D正确;
本题难度:一般