1、选择题
A.A>B
B.A=10-4 B
C.B=10-4A
D.A=B
参考答案:B
本题解析:本题有两种解法。
方法1(常规解法):NaOH(aq)中:
c水(OH-)=c水(H+)=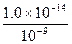 mol·L-1=1.0×10-5 mol·L-1
mol·L-1=1.0×10-5 mol·L-1
CH3COONa(aq)中:
c′水(OH-)=c′总(OH-)=10-9 mol·L-1
则A∶B=10-4
方法2(巧解法):NaOH(aq)中,水的电离被抑制;CH3COONa(aq)中,水的电离被促进;故A<B。
本题难度:一般
2、选择题 在H2O+CH3COO-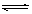 ?CH3COOH + OH—的平衡中,要使水解平衡向右移动,应采取的措施是
?CH3COOH + OH—的平衡中,要使水解平衡向右移动,应采取的措施是

A.加入NaOH固体
B.加入冰醋酸
C.增大压强
D.升高温度
参考答案:D
本题解析:根据水解方程式可知,溶液显碱性,所以加入氢氧化钠固体,抑制水解;题意加入冰醋酸也是抑制水解;增大压强,不影响水解平衡;水解是吸热的,所以升高温度促进水解,答案选D。
点评:固体是基础性试题的考查,试题注重基础,侧重能力的培养,有利于提高学生分析问题、解决问题的能力。该题的关键是明确水解平衡也是一种动态平衡,适用于勒夏特例原理。
本题难度:一般
3、选择题 下列事实能说明醋酸是弱酸的是?
①下当温度低于16.6℃时醋酸可凝结成冰一样晶体?②0.1 mol/L的醋酸钠溶液的pH约为9?③等体积等物质的量浓度的硫酸比醋酸消耗氢氧化钠多?④0.1mol/L的醋酸的pH值约为4.8?⑤pH等于4且等体积的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸液消耗碱液多
A.②④⑤
B.②④
C.②③④
D.②③
参考答案:A
本题解析:醋酸钠溶液是盐溶液应该PH为7,实际上是9说明醋酸根发生了水解,醋酸是弱酸,②正确;0.1mol/L的醋酸的pH值应该为1,实际上是4.8,说明醋酸分子没有全部电离,醋酸是弱酸,④正确;如果醋酸是强酸则pH等于4且等体积的醋酸和盐酸,与等浓度NaOH溶液充分反应时,消耗碱液的体积应该相同,实际上醋酸消耗的多说明醋酸是弱酸,溶液中存在没有电离的醋酸分子,所以耗碱增多,⑤正确;所以正确的是②④⑤答案选A。
本题难度:简单
4、选择题 室温下,有pH=3的盐酸、硫酸、醋酸(假设HAc的电离度为1%)三种相同体积的溶液。以下叙述错误的是
A.测定其导电性能相同
B.与足量的锌粉反应的起始速率相同
C.与足量的锌粉反应产生氢气的体积比为1∶1∶100
D.与同浓度氢氧化钠溶液反应,消耗氢氧化钠溶液的体积为1∶2∶100
参考答案:D
本题解析:A、pH=3的盐酸、硫酸、醋酸导电性能相同,正确;B、pH=3的盐酸、硫酸、醋酸,锌与氢离子反应,氢离子浓度相同,起始速率相同,正确;C、HAc的电离度为1%,PH="3" ,与足量的锌粉反应,HAc均被消耗,CHAc=10-3/1%=10-1,盐酸和硫酸的浓度与氢离子浓度相等,10-3, 足量的锌粉反应产生氢气的体积比为1∶1∶100,正确;D、,消耗氢氧化钠溶液的体积为1∶1∶100,错误。
本题难度:一般
5、选择题 在CH3COOH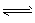 CH3COO-+H+的电离平衡中,要使电离平衡右移,且氢离子浓度增大,应采取的措施是?
CH3COO-+H+的电离平衡中,要使电离平衡右移,且氢离子浓度增大,应采取的措施是?
[? ]
A.加入NaOH固体
B.加浓盐酸
C.加水
D.加热
参考答案:D
本题解析:
本题难度:一般