| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《影响化学反应速率的因素》试题特训(2019年最新版)(二)
 △H2=-283 kJ·mol-1 △H2=-283 kJ·mol-1 △H3=-242 kJ·mol-1 △H3=-242 kJ·mol-1则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为 ; ③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答: 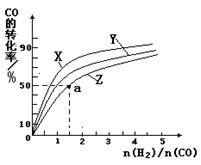 参考答案: 本题解析: 本题难度:困难 2、选择题 下列说法正确的是( ) 参考答案:A.增大反应物浓度,活化分子的浓度增大,但百分数不变,故A错误; 本题解析: 本题难度:一般 3、选择题 一定量的Fe与过量的稀硫酸反应制取氢气,一定温度下为加快反应速率而不影响氢气的量,可向其中加入 ( ) 参考答案:C 本题解析: Fe与过量的稀硫酸反应制取氢气,一定温度下为加快反应速率而又不影响氢气的量,加入KCl固体,不能改变H+的浓度,所以不能改变速率,A项错误;加入锌粉消耗氢离子,B项错误。SO3固体加入生成硫酸,H+浓度增加,加快速率。加入CuSO4晶体构成原电池,加快速率,但是和铁反应,影响氢气的量。 本题难度:一般 4、填空题 “碘钟”实验中,3I- +S2O82- =I3-+ 2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表,回答下列问题: 参考答案:(1)研究反应物I-与S2O42-的浓度对反应速率的影响 本题解析: 本题难度:一般 5、选择题 A(g)+B(g)?C(g);△H<0平衡后,若使温度由T1升到T2,(其他不变),则υ正与υ逆的变化曲线是( ) 参考答案:升高温度,正逆反应速率都增大,则B、D错误; 本题解析: 本题难度:简单 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《燃烧热》在.. | |