1、填空题 Ⅰ.有关物质存在如图所示的转化关系(部分产物已省略)。通常B为黑色粉末,C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。

请回答下列问题:
(1)反应①的化学方程式为________________________________;
(2)反应②的离子方程式为________________________________ ;
(3)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10—9。浓度为0.01mo1/L的D溶液与a mo1/L的Pb(NO3)2溶液等体积混合,则生成沉淀所需a的最小值为____________;
(4)电解F的溶液可以实现电能转化为化学能,请写出惰性电极电解足量的F溶液的离子方程式________________________________。
Ⅱ.辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2 H2O,该反应的还原剂是___________,当1mol O2发生反应时,还原剂所失电子的物质的量为______mol。向CuSO4溶液中加入镁条时有气体生成,该气体是____________。
参考答案:Ⅰ(1) MnO2 + 4HCl(浓) MnCl2 + H2O + Cl2↑?(2) 6I-+ClO3-+6H+=3I2+Cl-+3H2O
MnCl2 + H2O + Cl2↑?(2) 6I-+ClO3-+6H+=3I2+Cl-+3H2O
(3)5.6×10-4?(4) 2Cl-+ 2H2O  ?2OH- + H2↑ + Cl2↑
?2OH- + H2↑ + Cl2↑
Ⅱ.Cu2S;? 4;?氢气
本题解析:G为紫黑色固体单质,一般可预测为碘单质,可推得C物质为氯气,则A为盐酸、B为二氧化锰;E在二氧化锰的催化下制取H,则E为氯酸钾、H为氧气;F为氯化钾;于是D一定为碘化钾。所以推出A盐酸、B二氧化锰、C氯气、D碘化钾、E氯酸钾、F氯化钾、G碘、H氧气。
沉淀应为碘化铅PbO2,Ksp=碘离子浓度的平方乘以铅离子浓度,混合后碘离子浓度为0.005mo1/L,根据此式计算得Pb(NO3)2的物质的量浓度为5.6? × 10-4 mo1/L
(4)2Cl-+ 2H2O  ?2OH- + H2↑ + Cl2↑
?2OH- + H2↑ + Cl2↑
本题难度:一般
2、填空题 下图表示某些化工生产的流程(部分反应条件和产物略去)
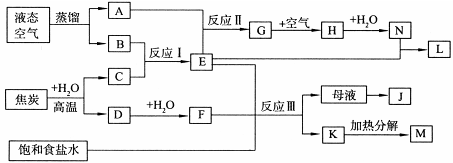
(1)反应Ⅰ需在500℃进行,其主要原因是?。
(2)G转化为H的过程中,需要不断补充空气,其原因是?。
(3)写出反应Ⅲ的化学方程式?。
(4)工业上,向析出K的母液中通氨气,加入细小食盐颗粒,冷却后可析出副产品。通入氨气的作用是?(填序号)。
a.增大NH+4的浓度,使J更多地析出
b.使K更多地析出
c.使K转化为M,提高析出的J的纯度
(5)写出上述流程所涉及的化学工业的名称?。
参考答案:(8分)
(1)此温度下催化剂活性最高(1分) ;
(2)使NO不断转化为NO2,提高原料的利用率(1分)
(3)NaCl+ NH3+CO2+H2O= NaHCO 3↓+ NH4Cl(1分)
(4)ac(2分)
(5)合成氨工业、氨催化氧化法制硝酸、侯德榜制碱法(1个1分,共3分)
本题解析:结合图片空气中主要是氮气与氧气,焦炭与水生成CO和氢气,结合反应Ⅰ、Ⅱ可知A.O2;B. N2;C. H2;D. CO;E. NH3;F. CO2;G. NO;H. NO2; J.NH4Cl;K. NaHCO 3;L.NH4NO 3;M. Na2CO 3;N. HNO 3;
(1)此温度下催化剂活性最高提高转化效率;
(2)使2NO+ O2=2NO2,提高原料的利用率。
(3)侯氏制碱法的主要反应:NaCl+ NH3+CO2+H2O= NaHCO 3↓+ NH4Cl。
(4)通入氨气增大NH+4的浓度,使NH4Cl更多地析出;使NaHCO 3转化为Na2CO 3,提高析出的NH4Cl的纯度;
(5)根据工艺流程可知主要有合成氨工业、氨催化氧化法制硝酸、侯德榜制碱法。
本题难度:困难
3、填空题 同学们,我们学习过的化学反应有很多了,让我们对所学过的化学反应方程式做个总结吧!有一些化学反应可用下式表示
A+B─→C+D+H2O
请你根据下面的提示回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式:______.
(2)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是______.
(3)若A为Na2O2,B为硫酸,则C和D的化学式是______.
(4)若A、C均含有铝元素.则C可能是______.写出一个符合这个反应的化学方程式:______
(5)若A为单质,B为第二周期某种元素的最高价氧化物的水化物,请写出符合上式的化学方程式:______.
参考答案:(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,氯元素发生歧化反应,氯气与碱的反应符合A+B→C+D+H2O转化关系,反应离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(2)C、D均为气体且都能使澄清石灰水变浑浊,为CO2、SO2,碳与浓硫酸在加热的条件下反应生成CO2、SO2、H2O,符合转化关系;
故答案为:碳与浓硫酸;
(3)若A为Na2O2,B为硫酸,发生反应2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O;
故答案为:Na2SO4、O2;
(4)若A、C均含有铝元素,产物有三种,铝与氢氧化钠溶液反应符合转化关系,C为H2;铝与氢氧化钠反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(5)若A为单质,B为第二周期某种元素的最高价氧化物的水化物,产物有三种,为单质与氧化性酸反应,A为碳,B为浓硝酸,符合转化关系,反应方程式为:C+4HNO3(浓)?△?.?CO2↑+4NO2↑+2H2O;
故答案为:C+4HNO3(浓)?△?.?CO2↑+4NO2↑+2H2O.
本题解析:
本题难度:一般
4、填空题 各物质有如图所示的转化关系,已知:
(1)化合物E与水反应生成白色浆状物
(2)化合物F是不成盐的氧化物?
(3)组成D的元素在化合物中只能显负一价
据此请填空
(1)化合物F是______
(2)化合物I是______
(3)反应(2)的化学方程式是______
(4)反应(4)的化学方程式是______.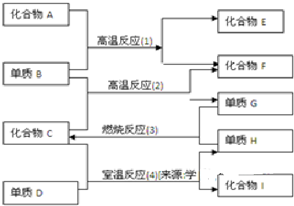
参考答案:反应(1)为高温下的反应,且化合物F为不成盐氧化物,则F为CO,B为C,则A为CaO或氧化铝,化合物E为CaC2或碳化铝;反应(2)为C与水蒸气的反应,所以C为水,G为H2,H为O2,单质D能置换出氧气,其氧化性比氧气的强,则D为F2,所以化合物I为HF,
(1)由上述分析可知,F为CO,故答案为:CO;
(2)由反应(4)的分析可知,I为HF,故答案为:HF;
(3)反应(2)的化学方程式为C+H2O(g)?高温?.?H2+CO,故答案为:C+H2O(g)?高温?.?H2+CO;
(4)反应(4)的化学方程式为2H2O+2F2═4HF+O2,故答案为:2H2O+2F2═4HF+O2.
本题解析:
本题难度:一般
5、填空题 (9分)已知X气体是一种无色有刺激性气味的酸性氧化物,有关X、Y、Z、W的转化关系如下,反应①~④均为化合反应。回答下列问题:
(1)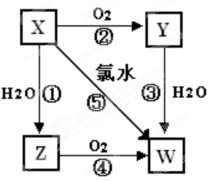
Y的化学式为___________,
Z的化学式为____________。X直接排入空气中
易造成的环境问题是_______________________。
(2)反应①~⑤中属于氧化还原反应的是_______________________________。
(3)写出反应⑤的化学方程式:_______________________________________________。
(4)写出铜与W反应的化学方程式:____________________________________________
参考答案:

本题解析:略
本题难度:一般