1、简答题 A、Z、R、D、E、F、G是七种原子序数依次增大且不大于20的元素,其中有两种非金属元素位于同一主族.己知A、Z、D均能与R形成原子(或离子)个数不同的儿种常见化合物.请回答下列有关问题.
(1)若X、Y是D、F形成的最高价氧化物对应的水化物,浓度均为0.1mol/L的X、Y溶液的pH之和为14,则X、Y的晶体熔点相对高低为(写化学式)______,导致这种差异存在的原因是______在相同温度下,相等物质的量浓度的X、Y各自的溶液中,由水电离出的c(H+)的相对大小关系为______.
(2)A与Z、E均可形成正四面体构型的气态分子Q、P,又知P的燃烧热为1430kJ/mol.则其燃烧的热化学方程式______.
(3)R与D、F间;R与F、G间均可形成多种化合物,其中有两种是目前广泛使用的具有消毒杀菌能力的化合物.则相同物质的量浓度的这两种物质的溶液,消毒杀菌能力较强的物质的化学式为______,另一种物质的溶液中,各离子浓度由大到小的顺序为______.
(4)上述七种元素间能形成多种常见二元化合物,其中Z与G形成的一种化合物存在两类化学键的物质溶于HC1溶液的化学反应方程式为______,ZR2的电子式是______,该分子的空间构型为______化合物ZRF2的结构式为______
(5)R能形成多种单质,如R2、R3,研究表明,新近制得的一种组成为R4的分子中,每个R原子均与另外两个R原子各形成一个键,则1molR4中共用电子对数为______NA,列有关R4的说法中正确的是______
①R4与R3、R2互为同位素
②R4不能与A、Z、D的单质反应
③R4中各原予最外层均为8电子结构
④R4是1种新型化合物.
参考答案:由分析可知,A为氢元素、Z为碳元素、R为氧元素、D为Na元素、E为Si元素、F为氯元素、G为钙元素.
(1)D、F形成的最高价氧化物对应的水化物分别为NaOH、HClO4,NaOH为离子晶体,HClO4形成分子晶体,离子键强于分子间作用力,所以晶体熔点NaOH>HClO4;氢氧化钠溶液中氢离子浓度为Kwc(OH-),高氯酸溶液中水电离的氢离子浓度等于溶液中氢氧根离子浓度为Kwc(H+),在相同温度下,相等物质的量浓度的NaOH、HClO4的溶液,氢氧化钠溶液中c(OH-)等于高氯酸溶液中c(H+),所以Kwc(OH-)=Kwc(H+),即在相同温度下,相等物质的量浓度的X、Y各自的溶液中,由水电离出的c(H+)相等.
故答案为:NaOH>HClO4;NaOH为离子晶体,HClO4形成分子晶体,离子键强于分子间作用力;相等.
(2)P为SiH4,燃烧热为1430kJ/mol,燃烧的热化学方程式为SiH4(g)+2O2(g)=SiO2(s)+2H2O(l),△H=1430kJ/mol.
故答案为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l),△H=1430kJ/mol.
(3)相同浓度的次氯酸钠溶液与次氯酸钙溶液,次氯酸钙溶液中次氯酸根离子浓度更大,所以Ca(ClO)2 消毒杀菌能力较强;NaClO溶液中,次氯酸根水解,溶液呈碱性,水解程度不大,次氯酸根远远大于氢氧根离子浓度,所以 离子浓度Na+>ClO->OH->H+.
故答案为:Ca(ClO)2;Na+>ClO->OH->H+.
(4)上述七种元素间能形成多种常见二元化合物,其中Z与G形成的一种化合物存在两类化学键,该物质为CaC2,
CaC2与HC1溶液反应生成氯化钙与乙炔,反应化学反应方程式为CaC2+2HCl=CaCl2+C2H2↑;ZR2为CO2,碳原子与氧原子之间形成2对共用电子对,电子式是
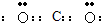
,为直线型结构;化合物ZRF2是COCl2,氯原子与羰基相连,结构式为
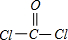
.
故答案为:CaC2+2HCl=CaCl2+C2H2↑;
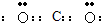
;直线型;
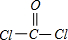
.
(5)R4的分子为O4,分子中每个O原子均与另外两个O原子各形成一个键,最外层达8电子结构,分子中共价键为8×4-6×42=4,则1molO4中共用电子对数为 4NA.
①O4与O3、O2都是氧元素形成的结构不同的单质,互为同素异形体,故①错误;
②O4与O3、O2都是氧元素形成的结构不同的单质,互为同素异形体,化学性质相似,所以O4与氢、碳、钠的单质反应,故②错误;
③O4分子中,每个O原子均与另外两个O原子各形成一个键,最外层达8电子结构,故③正确;
④O4是氧元素形成的单质,故④错误.
故答案为:4;③.
本题解析:
本题难度:一般
2、选择题 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如下的?转化关系(部分产物及反应条件已略去):
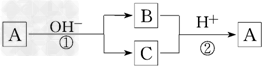
下列判断正确的是
[? ]
A.X元素可能为Al
B.X元素一定为金属元素
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
参考答案:D
本题解析:
本题难度:一般
3、填空题 下图涉及多种无机化工反应,所涉及物质都是由短周期元素组成,其中R是一种新型无机材料,M是一种应用广泛的金属材料,F是人工合成的第一种有机物,且是一种常见的化肥材料,A、C、D、M均为常见元素的单质,“↑”表示该物质常温下是气体,反应G+J→F+H2O中G与J的最佳配比为2:1,向Y溶液中通入足量的J气体时可得到一种白色胶状沉淀,将该白色胶状沉淀滤出洗净后加热分解可以得到B。
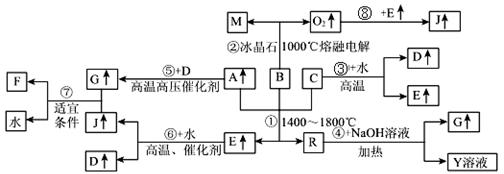
请回答下列问题:
(1)写出B化学式?,F化学式:?;G的空间构型?。
(2)反应①的化学方程式为?
(3)反应④的离子方程式为?
(4)上述反应中属于非氧化还原反应的有?(填写相应反应的序号)
(5)Y溶液呈?性(填酸、碱或中),用离子方程式解释?
参考答案:(1)Al2O3(1分)? CO(NH2)2(1分)?三角锥形(1分)
(2)N2+Al2O3+3C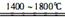 3CO+2AlN(2分)
3CO+2AlN(2分)
(3)AlN+OH—+H2O=AlO2—+NH3↑(2分)?(4)④⑦(2分)
(5)碱(1分)? AlO2—+2H2O Al(OH)3+OH—?(2分)
Al(OH)3+OH—?(2分)
本题解析:F是人工合成的第一种有机物,则F时尿素,化学式为 CO(NH2)2。向Y溶液中通入足量的J气体时可得到一种白色胶状沉淀,将该白色胶状沉淀滤出洗净后加热分解可以得到B,所以B是氧化铝,因此M是铝。根据反应⑤的条件可知,A是氮气,D是氢气,G是氨气。根据2G+J→F+H2O可知,J是CO2,所以E是CO。根据反应③可知C是碳。根据反应④中,R是AlN,Y是偏铝酸钠。偏铝酸钠水解显碱性,方程式为
AlO2—+2H2O Al(OH)3+OH—。
Al(OH)3+OH—。
本题难度:一般
4、填空题 (8分)A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
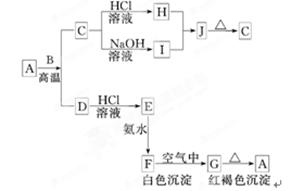
(1)写出下列物质的化学式:
A:________,E:________,J:________,G:________. (2)按要求写方程式:
A与B在高温条件下生成C和D的化学方程式:
______________________________________________________;
C转化为I的离子方程式:?
参考答案:.A:Fe2O3? E:FeCl2? J:Al(OH)3? G:Fe(OH)3?2Al+2OH-+2H2O=2AlO2-+3H2↑
本题解析:本题是无机框图题,关键是找准突破点。A是一种红棕色金属氧化物,G是红褐色沉淀,所以G是氢氧化铁,A是氧化铁。所以F是氢氧化亚铁,E是氯化亚铁,D是铁,B是铝,C是氧化铝,H是氯化铝,I是偏铝酸钠,J是氢氧化铝。
本题难度:一般
5、填空题 (10分)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
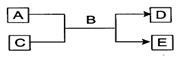
(1)常温下,若A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,相对分子质量E>D,
则该反应的化学方程式为:?,
检验D中阴离子所用试剂为:?。
(2)若A为短周期的金属单质,D为气态单质,C溶液呈酸性或强碱性时,该反应都能进行。写出C
溶液呈强碱性时反应的离子方程式:?。
(3)若A、C均为化合物,E为白色沉淀,C为引起温室效应的主要气体,写出E可能的物质的化学式(写两种):?,?。
参考答案:(10分)(1)? Cl2 + SO2 + 2H2O = H2SO4 + 2 HCl(2分)
AgNO3溶液,?稀HNO3(只答AgNO3溶液不给分)(2分)
(2)? 2Al + 2 OH- + 2H2O ="2Al" O2- + 3H2↑(2分)? (3) H2SiO3? Al(OH)3?(每空2分)
本题解析:B为自然界中含量最多的液体,则B是水。(1)如果A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,则A应该是氯气,C是SO2,反应的方程式是Cl2 + SO2 + 2H2O = H2SO4 + 2 HCl。相对分子质量E>D,所以E是硫酸,D是氯化氢。实验室检验氯离子的试剂是硝酸酸化的硝酸银。
(2)A为短周期的金属单质,D为气态单质,C溶液呈酸性或强碱性时,该反应都能进行,所以A是单质铝,和强碱反应的离子方程式是2Al + 2 OH- + 2H2O ="2Al" O2- + 3H2↑。
(3)C为引起温室效应的主要气体,则C是CO2。又因为A、C均为化合物,E为白色沉淀,所以该反应是碳酸制取比碳酸还弱的酸的复分解反应,所以E可能是硅酸或氢氧化铝。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般