1、选择题 下列叙述正确的是
A.1 mol H2O的质量为18g·mol-1
B.质量数为37的氯原子 17 37Cl
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1 mol任何物质体积均为22.4L
参考答案:C
本题解析:A、g·mol-1是摩尔质量的单位,错误;B、质量数为37的氯原子应表示为1737Cl,错误;C、3.01×1023个SO2分子的物质的量为0.5mol,其质量为32g,正确;D、标准状况下,1 mol任何气体的体积约为22.4L,而不是任何物质,错误,答案选C。
本题难度:一般
2、选择题 下列说法正确的是
A.7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023
B.标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.0×6.02×1023
C.2.24LSO2与O2混合气体中所含氧原子数为0.2×6.02×1023
D.Vlamol·L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023
参考答案:D
本题解析:氯气与NaOH转移电子为;Cl2~e?,7.1g氯气反应转移的电子数为0.1×6.02×1023,A项错;NO与O2反应生成NO2,2 NO2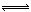 N2O4,分子数减少,所以混合后气体的分子总数<1.0×6.02×1023,B项错;C项没有注明外界条件,2.24LSO2的物质的量不确定;因为Fe3+水解,所以Cl?的数目大于Fe3+数目的3倍,D项正确。
N2O4,分子数减少,所以混合后气体的分子总数<1.0×6.02×1023,B项错;C项没有注明外界条件,2.24LSO2的物质的量不确定;因为Fe3+水解,所以Cl?的数目大于Fe3+数目的3倍,D项正确。
本题难度:一般
3、选择题 NA代表阿伏加德罗常数的值,下列说法正确的是(?)
A.标准状况下,11.2L四氯化碳所含分子数为0.5NA
B.pH=2、体积为1L的醋酸溶液中含醋酸分子的数目为0.01NA
C.7.8g Na2O2中阴、阳离子总数为0.4NA
D.4.5g SiO2晶体中含有的硅氧键数目为0.3NA
参考答案:D
本题解析:标准状况下,四氯化碳为液态,不可以用22.4L/mol来换算,故A不正确;醋酸为弱电解质,在溶液中部分电离,0.01NA是溶液中H+的数目,故B不正确;Na2O2中的阴离子为O22-,7.8g Na2O2中的物质的量为0.1mol,其阴、阳离子总数为0.3NA,故C不正确。
本题难度:简单
4、选择题 0.2g H2、8.8g CO2、5.6gCO组成的混合气体,其密度是相同条件下O2的密度的
A.0.913倍
B.1.852倍
C.0.873倍
D.1.631倍
参考答案:A
本题解析:略
本题难度:简单
5、填空题 将一定体积的CO2缓缓通入体积为VL的NaOH溶液中,充分反应后,在减压低温的条件下蒸发溶液,得到白色固体(每空2分)
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,推断并写出各种可能组成的化学式(可以不填满,也可以增加序号)
①?,②?,③?,④?。
(2)按反应的先后顺序写出各步反应的离子方程式:
??、?。
(3)若反应的CO2和NaOH均无剩余,反应后向溶液中加入过量的澄清石灰水生成a克白色沉淀根据以上数据,能否推理计算出CO2的质量?
若能,用代数式表示的质量m(CO2)=?若不能,理由是?。
参考答案:(每空2分)
(1) ①?氢氧化钠和碳酸钠,②碳酸钠,③碳酸钠和碳酸氢钠,④碳酸氢钠?。
(2)2OH-+CO2==CO32-+H2O?CO32-+CO2+H2O==2HCO3-。(3)m(CO2)=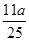
本题解析:(1)①当CO2与NaOH的物质的量比小于1:2时,由反应CO2+2NaOH═Na2CO3+H2O可知反应生成碳酸钠,还有剩余的NaOH,减压低温的条件下蒸发溶液,得到白色固体为NaOH和Na2CO3 ;②当二氧化碳与NaOH的物质的量为1:2时,反应CO2+2NaOH═Na2CO3+H2O恰好完全进行,则溶液中的溶质为Na2CO3,减压低温的条件下蒸发溶液,得到白色固体为Na2CO3 ;③当二氧化碳与NaOH的物质的量比大于1:2,而小于1:1时,发生CO2+2NaOH═Na2CO3+H2O、CO2+NaOH═NaHCO3,减压低温的条件下蒸发溶液,得到白色固体为Na2CO3和NaHCO3 ;④当二氧化碳与NaOH的物质的量比≥1:1时,发生CO2+NaOH═NaHCO3,减压低温的条件下蒸发溶液,得到白色固体为NaHCO3,所以答案为:NaOH和Na2CO3 ;Na2CO3;Na2CO3和NaHCO3 ;NaHCO3。(2)按反应的先后顺序各步反应的离子方程式是2OH-+ CO2=CO32-+H2O?、CO32-+CO2+H2O=2HCO3-?。
(3)反应中CO2和NaOH均无剩余,溶液中的溶质可能为Na2CO3,也可能为NaHCO3,还可能为Na2CO3和NaHCO3 ,加入过量的澄清石灰水生成ag白色沉淀。由于碳酸钠和碳酸氢钠都能和氢氧化钙反应生成白色沉淀,则根据碳原子守恒,可计算出CO2的物质的量为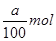 ,则CO2的质量是
,则CO2的质量是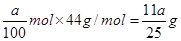 。2反应的有关判断和计算
。2反应的有关判断和计算
点评:该题综合性强,难度较大。该题的关键是明确反应的原理,并能熟练写出发生反应的化学反应方程式,然后利用极端假设,并结合原子守恒来解答。有利于培养学生的逻辑推理能力和发散思维能力,提高学生的应试能力和学习效率。
本题难度:一般