1、选择题 反应H2(g)+ I2(g) 
 ?2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是(? )
?2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是(? )
①单位时间内断裂n mol H-H键的同时形成2n mol H-I键 ②单位时间内生成n molI2的同时生成2n molHI?
A.②④⑤⑥
B.②③④⑤
C.①③④⑤
D.全部
参考答案:B
本题解析:达到化学平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于化学计量数之比(不同物质),各物质的浓度、质量、物质的量、百分含量不变。①单位时间内断裂n mol H-H键的同时形成2n mol H-I键,都描述的正反应方向的变化,错误;②单位时间内生成n molI2的同时生成2n molHI,说明反应v正=v逆,达到平衡状态,正确;③2v正(H2)=v逆(HI),正确;④HI分子数不再改变,即其浓度不再改变,正确;⑤混合气体颜色不再改变,即碘单质的浓度不再改变,正确;⑥该化学反应是气体物质的量不变的反应,故混合气体压强不再改变不能用来判断是否平衡,故错误。
本题难度:一般
2、选择题 对于可逆反应:2A(g)+B(g)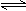 2C(g)?△H<0,下列各图正确的是(?)
2C(g)?△H<0,下列各图正确的是(?)

A? B? C? D
参考答案:A
本题解析:B、增大压强,正逆反应速率同时增大,平衡向正向移动;
C、催化剂不能使平衡移动,平衡时c(C)相同;
D、温度升高,平衡逆向移动,A的转化率减小,故100℃在下。
本题难度:一般
3、选择题 四位同学同时进行反应:A(g)+3B(g)=2C(g)+2D(g)?的速率测定实验,分别测得反应速率如下:①v(A)=0.15mol/(L·s)?②v(B)=0.6mol/(L·s)?③v(C)=0.4mol/(L·s)?④v(D)=?0.45mol/(L·s)。其中,反应进行得最快的是
[? ]
A.①?
B.②?
C.③?
D.④
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列情况下,反应速率相同的是
[? ]
A.等体积0.1 mol/L HCl和0.1 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应
B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应
C.等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应
D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应
参考答案:C
本题解析:
本题难度:一般
5、简答题 将等物质的量的A、B混合于2L的密闭容器中发生反应3A(g)+B(g)═xC(g)+2D(g),经5min后,测得D的浓度为0.5mol?L-1,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L?min).则:
(1)此时,A的物质的量浓度为______;
(2)反应开始前容器中A、B的物质的量为______;
(3)B的平均反应速率为______;
(4)x的值为______.
参考答案:D的浓度为0.5mol/L,所以D的物质的量为1mol.
设A、B的物质的量为nmol,
3A(g)+B(g)=xC(g)+2D(g),
开始 n mol n mol 0 0
反应 1.5mol 0.5mol1mol
5min (n-1.5)mol( n-0.5)mol 1mol
同一容器中,c(A):c(B)=n(A):n(B)=n-1.5n-0.5=35;n=3mol;
(1)A在5min末的物质的量为:(n-1,5)mol=1.5mol,其物质的量浓度为0.75mol/L,故答案为:0.75mol/L;
(2)由计算可知n=3mol,故答案为:3mol;
(3)C的反应速率是0.1mol/(L?min),根据同一反应中,各物质的反应速率之比等于计量数之比,所以B的反应速率是0.05mol/(L?min),
故答案为:0.05mol/(L?min);
(4)D的浓度为0.5mol/L,反应时间为5min,D的反应速率为0.1mol/(L?min),C的反应速率是0.1mol/(L?min),根据同一反应中,各物质的反应速率之比等于计量数之比,所以x=2,故答案为:2.
本题解析:
本题难度:简单