1、选择题 对于反应2H2O2 2H2O+O2↑,下列说法正确的是(?)
2H2O+O2↑,下列说法正确的是(?)
A.H2O2是氧化剂
B.O2是还原产物
C.H2O2既是氧化剂,又是还原剂
D.H2O是氧化产物
参考答案:C
本题解析:氧化还原反应中,氧化剂、还原剂可以是同一种物质,氧化产物、还原产物也可是同一种物质;对于该反应,H2O2既是氧化剂又是还原剂,从化合价升降角度可判定O2是氧化产物,H2O是还原产物。
本题难度:一般
2、选择题 在常压和500℃条件下,等物质的量的Ag2O,Fe(OH)3 ,NH4HCO3 ,NaHCO3完全分解,所得气体体积依次是V1、V2、V3、V4.体积大小顺序正确的是
A.V3>V2>V4>V1
B.V3>V4>V2>V1
C.V3>V2>V1>V4
D.V2>V3>V1>V4
参考答案:A
本题解析:四种物质的受热分解化学方程式为:A、2Ag2O=4Ag+O2↑? B、2Fe(OH)3=Fe2O3+3H2O↑? C、NH4HCO3=NH3↑+H2O↑+CO2↑? D、2NaHCO3=Na2CO3+CO2↑+H2O↑?所以,等物质的量的四种物质完全分解所放气体体积大小依次为V3>V2>V4>V1
点评:考查化学方程式的有关计算,难度不大。
本题难度:简单
3、选择题 下列说法中,正确的是
A.ΔH>0 kJ/mol表示放热反应,ΔH<0 kJ/mol表示吸热反应
B.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫中和热
C.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
D.热化学方程式中的化学计量数表示物质的量,所以可以是分数
参考答案:D
本题解析:A项ΔH>0 kJ/mol表示吸热反应,ΔH<0 kJ/mol表示放热反应;B项中和热是指生成1mol 水所放出的热量;C项燃烧热必须要生成稳定的氧化物,也就是水的状态决定是不是燃烧热;D项热化学方程式中的系数表示的是物质的量,不是分子个数,所以可以为整数也可以为分数。答案选D。
点评:中和热和燃烧热的概念要注意。
本题难度:一般
4、选择题 已知热化学方程式:SO2(g)+ 1/2O2(g)  ?SO3(g)?△H = ―98.32kJ/mol,在容器中充入2molSO2?和1molO2充分反应,最终放出的热量为
?SO3(g)?△H = ―98.32kJ/mol,在容器中充入2molSO2?和1molO2充分反应,最终放出的热量为
A.196.64kJ
B.196.64kJ/mol
C.<196.64kJ
D.>196.64kJ
参考答案:C
本题解析:反应SO2(g)+ 1/2O2(g)  ?SO3(g)?△H = ―98.32kJ/mol为可逆反应,其反应热表示为反应物完全转化为生成物时所放出的热量,而实际上反应物不能完全转化为生成物,所以,当在容器中充入2molSO2?和1molO2充分反应,最终放出的热量小于196.64kJ
?SO3(g)?△H = ―98.32kJ/mol为可逆反应,其反应热表示为反应物完全转化为生成物时所放出的热量,而实际上反应物不能完全转化为生成物,所以,当在容器中充入2molSO2?和1molO2充分反应,最终放出的热量小于196.64kJ
本题难度:简单
5、选择题 下列说法正确的是?(?)
①用25mL酸式滴定管可以准确放出8.00mL的稀盐酸;
②可用干燥的pH试纸测定氯水的pH;
③使用容量瓶配制溶液,定容时俯视,所得溶液的浓度偏大;
④加入盐酸有使澄清石灰水变浑浊的无色气体生成,则原溶液中一定有大量CO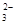 存在;
存在;
⑤在某温度下,醋酸与氢氧化钠溶液混合,溶液呈碱性,溶液中离子浓度大小的关系一定为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
⑥右图是反应物和生成物的能量示意图,其可能发生反应的热化学方程式:2A(g)+B(g) 2C(g)? △H=QkJ·mol-1(Q<0)
2C(g)? △H=QkJ·mol-1(Q<0)

A.①③⑥
B.②④⑤
C.①③④
D.③⑤⑥
参考答案:A
本题解析:②错,氯水具有酸性、强氧化性、漂白性等,不可用PH试纸测定氯水的PH值;④错,加入盐酸有使澄清石灰水变浑浊的无色气体生成,则原溶液中可能有CO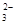 或HCO3—存在;⑤错,可以为氢氧化钠大大过量,即c(Na+)>c(OH-)>c(CH3COO-)>c(H+);
或HCO3—存在;⑤错,可以为氢氧化钠大大过量,即c(Na+)>c(OH-)>c(CH3COO-)>c(H+);
本题难度:一般