1、选择题 根据下图,判断下列说法中错误的是(? )
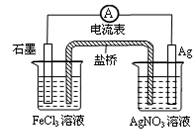
A.导线上电子由Ag极流向石墨极
B.负极电极反应式:Fe3+ + e-=Fe2+
C.盐桥中阴离子移向AgNO3溶液
D.总反应为:Fe3+ + Ag=Fe2+ + Ag+
参考答案:B
本题解析:该装置为原电池,其电池的总反应式为Fe3+ + Ag=Fe2+ + Ag+,其负极的反应为Ag-e-=Ag+,正极发生的反应为Fe3+ + e-=Fe2+;该电池中,导线上电子由Ag极流向石墨极,电流为由石墨经导线流向Ag极,故A正确;负极电极反应式:Ag-e-=Ag+,故B错误,为本题的答案;盐桥中阴离子移向AgNO3溶液,故C正确;总反应为:Fe3+ + Ag=Fe2+ + Ag+,故D正确。
点评:本题考查了原电池的基础知识,该考点是高考考查的重点和难度,本题比较容易,注意本题选择的是错误的一项。
本题难度:简单
2、选择题 原电池结构如图所示,下列有关该原电池的说法正确的是
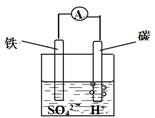
A.能将电能转换成化学能
B.电子从碳棒经外电路流向铁棒
C.碳棒发生氧化反应
D.总反应为 Fe+H2SO4= FeSO4+H2↑
参考答案:D
本题解析:根据原电池的原理,铁为原电池的负极,铁失去电子给硫酸电离出的H+,生成氢气,发生氧化反应,C错;原电池是将化学能转变成电能,A错;电子从铁棒经过外电路流向碳棒,B错;正极反应和负极反应相加得总反应为 Fe+H2SO4= FeSO4+H2↑。选D
点评:本道题目是高考中必考的知识点之一,即原电池的原理及其应用,其中判断电流方向,正、负极发生的化学反应式是常考的。
本题难度:一般
3、选择题 关于下图所示装置的说法中,正确的是?
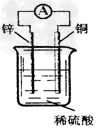
[? ]
A.铜片上发生氧化反应
B.电子由铜片通过导线流向锌片?
C.该装置能将化学能转化为电能?
D.锌片是该装置的正极,该电极反应为Zn+2e-==Zn2+
参考答案:C
本题解析:
本题难度:一般
4、选择题 (2014届江西省八校高三下学期联考理综化学试卷)
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)的传感器煤矿巷道中的甲烷达到一定浓度时可以显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述不正确的是
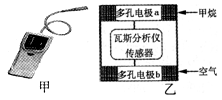
A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极b流向电极a
C.电极a的反应式为:CH4 + 4O2- - 8e- = CO2 + 2H2O
D.当固体电解质中有1 molO2- 通过时,电子转移2 mol
参考答案:A
本题解析:
A、电子不能在电池内电路流动,只能在外电路中流动,故A错误;B、电极b氧气得电子,生成O2-,而电极a需要O2作为反应物,故O2-由正极(电极b)流向负极(电极a),故B正确;C、甲烷所在电极a为负极,电极反应为:CH4+4O2--8e-=CO2+2H2O,故C正确;D、1mol?O2得4mol电子生成2molO2-,故当固体电解质中有1mol?O2-通过时,电子转移2mol,故D正确;故选A。
本题难度:一般
5、选择题 化学中常用图象直观地描述化学反应的进程或结果。下列图象描述正确的是(? )
参考答案:A
本题解析:A:合成氨过程中,正反应速率逐渐减小,逆反应速率由0逐渐增大,平衡时,由不同物质表示正逆反应速率时,数值上符合系数比,正确
B:通入氨气生成醋酸铵强电解质,溶液导电性增强,不正确
C:随着碳的时的增加,依次发生反应:C+O2=CO2? CO2+C=2CO,可见当碳小于1mol时,产物为CO2,当大于1mol后,CO2的量逐渐减小到0,而CO的量由0逐渐增大到2mol,不正确
D:由于发生:Ca2++HCO3-+OH-=CaCO3↓+H2O,故一开始就有沉淀生成,不正确
答案为A
本题难度:一般