1、选择题 下列能用勒夏特列原理解释的是( )
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.升高温度,化学反应速率加快
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
参考答案:A、Fe(SCN)3溶液中加入同体KSCN后颜色变深,是因为Fe3++3SCN-?Fe(SCN)3,平衡正向移动,颜色加深,故A正确;
B、升温,反应速率加快,与平衡移动无关,故B错误;
C、催化剂能同等程度地增大正逆反应速率,不会影响平衡移动,故C错误;
D、反应方程式为,H2(g)+I2(g)=2HI(g),可见,反应前后的气体体积相同,加压平衡不移动,颜色变深是因为体积减小时碘蒸气浓度变大,故D错误.
故选A.
本题解析:
本题难度:简单
2、选择题 一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)
2CO2(g)+S(l)△H<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应平衡常数不变
参考答案:D
本题解析:
本题难度:一般
3、填空题 一定温度下在体积为5 L的密闭容器中发生可逆反应。
(Ⅰ)若某可逆反应的化学平衡常数表达式为: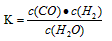
(1)写出该反应的化学方程式:____________________;
(2)能判断该反应一定达到化学平衡状态的依据是____________(填选项编号)。
A. 容器中气体的平均相对分子质量不随时间而变化
B. υ正(H2O)=υ逆(H2)
C. 容器中气体的密度不随时间而变化
D. 容器中总的物质的量不随时间而变化
E. 消耗n mol H2的同时消耗n mol CO
(Ⅱ)若该密闭容器中加入的是2molFe(s)与1mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol 。
(1)t1~t2这段时间内的化学反应速率v(H2)=____________。
(2)若继续加入2 mol Fe(s),则平衡_______移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(3)该反应的逆反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件可能是____________、____________。(填写2项)

参考答案:(Ⅰ)(1)C(s)+H2O(g)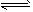 CO(g)+H2(g);(2)ABC
CO(g)+H2(g);(2)ABC
(Ⅱ)(1)0.03/(t2-t1) mol·L-1·s-1;(2)不;(3)使用了催化剂;升高了温度(或增大了H2的浓度)
本题解析:
本题难度:一般
4、选择题 一定温度下,在某密闭容器中发生反应:H2(g)+I2(g)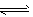 2HI(g)并达到平衡状态。若保持温度不变,在t0时刻改变外界条件,反应速率发生如下图所示的变化。则下列关于反应容器及反应条件变化的说法中正确的是
2HI(g)并达到平衡状态。若保持温度不变,在t0时刻改变外界条件,反应速率发生如下图所示的变化。则下列关于反应容器及反应条件变化的说法中正确的是
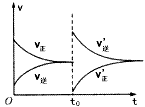
[? ]
A.容器为恒压容器时,充入适量He
B.容器为恒压容器时,充入适量HI
C.容器为恒容容器时,充入适量He
D.容器为恒容容器时,充入适量HI
参考答案:B
本题解析:
本题难度:一般
5、选择题 对于处于化学平衡状态的反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,若要提高CO的转化率,下列措施中可行的是( )
A.升温
B.增大H2O(g)的浓度
C.增大压强
D.使用合适催化剂
参考答案:A.该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,CO的转化率降低,故A错误;
B.增大水蒸气的浓度,平衡向正反应方向移动,水的转化率降低,但CO的转化率增大,故B正确;
C.该反应前后气体的体积不发生变化,增大压强平衡不移动,CO的转化率不变,故C错误;
D.使用催化剂,加快反应速率,不影响平衡移动,CO的转化率不变,故D错误;
故选B.
本题解析:
本题难度:一般