|
|
|
高考化学知识点归纳《影响化学反应速率的因素》练习题(八)
2019-05-30 04:54:07
【 大 中 小】
|
1、选择题 下列有关化学反应速率的说法正确的是
[? ]
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
参考答案:D
本题解析:
本题难度:一般
2、选择题 足量的镁与一定质量的盐酸反应,由于反应速率太快,若要减慢反应速率,但不能影响产生氢气的总质量,可以加入的物质是
A.CuSO4
B.NaOH
C.K2CO3
D.CH3COONa
|
参考答案:D
本题解析:根据发生的反应为Mg+2H+
本题难度:简单
3、选择题 (1)控制变量是科学研究中的重要研究方法,其基本思路是,在实验研究中人为只改变一个因素(调节变量),其他因素保持相同,观察测定因调节变量改变而改变的因素(因变量),从而分析得到研究结论。中学化学中应用控制变量的方法研究问题的例子很多。请分析或设计:
①在研究浓度对化学反应速率的影响时,教材安排了利用Na2S2O3与H2SO4反应的一组对照实验(Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O)
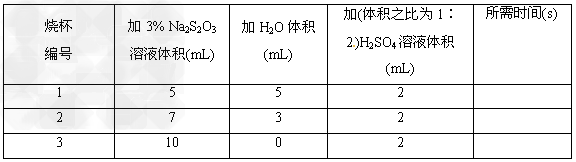
在三个烧杯(底部有黑色“十”字标记)内分别加入表中所示体?积的三种液体,搅拌并开始计时,到出现浑浊使烧杯底部“十”字看不见时停止计时。比较所需时间,得出浓度对化学反应速率影响的结论。实验中,温度和反应体系中硫酸浓度是保持相同的因素,调节变量是____________________,因变量是______________。
②运用控制变量原理设计实验,利用纯碱溶液探究温度对盐的水解的影响,简述实验方法:____________________________________________________________________________________________________________________。
(2)373?K时,H2PO3-与OH-发生如下反应:H2PO3-+OH- HPO32-+?H2O 反应结果如下表所示 HPO32-+?H2O 反应结果如下表所示
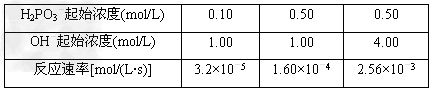
如果用v=kcm(H2PO3-)·cn(OH-)表示反应速率(k为与浓度无关的常数)
①k=________,m=________,n=________。
②若c(H2PO3-)的起始浓度为0.20?mol/L,c(OH-)的起始浓度为1.50?mol/L,则反应速率v=
________。
参考答案:(1)①Na2S2O3溶液的浓度;所需时间;②取三支试管各放同浓度同体积的纯碱溶液,滴1~2滴酚酞试液,第一支不加热,第二支加热至t1?℃,第三支加热至t2?℃,观察三支试管中溶液的颜色深浅,温度越高,颜色越深,说明碱性越强,则水解程度越大(其他合理答案均可)
(2)①3.2×10-4;1;2;②1.44×10-4mol/(L?s)
本题解析:
本题难度:一般
4、选择题 下列有关活化分子的说法正确的是
[? ]
A.增大反应物浓度可以提高活化分子百分数
B.增大压强一定能提高单位体积内活化分子总数
C.使用合适的催化剂可以降低活化分子的能量
D.升高温度一定能提高活化分子百分数
参考答案:D
本题解析:
本题难度:一般
5、选择题 同时符合下列两个图象的反应是(温度T1>T2)( )
A.N2O3(g)?NO2(g)+NO(g);△H>0
B.H2(g)+I2(g)?2HI(g);△H>0
C.3NO2(g)+H2O(l)?2HNO3(l)+NO(g);△H<0
D.4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H<0
|
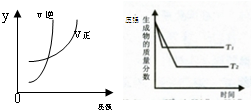
参考答案:A、可逆反应N2O3(g)?NO2(g)+NO(g)△H>0,正反应为吸热反应,且正反应为气体物质的量增大,增大移动平衡线逆反应移动,符合图象变化,故A正确;
B、可逆反应H2(g)+I2(g)?2HI(g)△H>0,正反应为吸热反应,但反应前后气体的物质的量不变,压强增大平衡不移动,不符合图象变化,故B错误;
C、可逆反应3NO2(g)+H2O(l)?2HNO3(l)+NO(g)△H<0,正反应为放热反应,正反应为气体物质的量减小,故C错误;
D、可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,正反应为放热反应,正反应为气体物质的量增大,不符合可逆反应特征,故D错误.
故选A.
本题解析:
本题难度:简单
