1、实验题 下表是稀硫酸与某金属反应的实验数据:
实验序号
| 金属质量/g
| 金属状态
| c(H2SO4)
/mol·L-1
| V(H2SO4)
/mL
| 溶液温度/℃
| 金属消失的时间/s
|
反应前
| 反应后
|
1
| 0.10
| 粉末
| 0.5
| 50
| 20
| 35
| 50
|
2
| 0.10
| 块状
| 0.8
| 50
| 20
| 35
| 200
|
3
| 0.10
| 粉末
| 0.8
| 50
| 20
| 36
| 25
|
4
| 0.10
| 块状
| 1.0
| 50
| 20
| 35
| 125
|
分析上述数据,请回答下列问题。
(1)实验1和3表明, 对反应速率有影响,能表明这种影响因素的实验还有 (填实验序号)。
(2)本实验中影响反应速率的其他因素还有 ,其实验序号是 。该实验说明 ,则反应速率越快;
(3)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:
&来源:91考试网 91eXAm.org#160; 。
2、选择题 用铁片与稀硫酸反应制取氢气时,下列措施不能使生成氢气的速率加快的是( )
A.加热
B.降温
C.滴加少量CuSO4溶液
D.不用铁片,改用铁粉
3、填空题 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用
kJ·mol-1表示。请认真观察下图,然后回答问题。
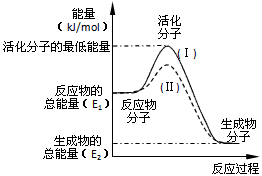
(1)图中所示反应是________(填“吸热”或“放热”)反应,该反应_______(填“需要”或“不需要”)加热,该反应的△H =________ (用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+O2(g) = H2O(g) △H = - 241.8 kJ·mol-1,该反应的活化能为
167.2 kJ·mol-1,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是_________________________。
4、选择题 下列各组实验中,过氧化氢分解最快的是( )
| ? | H2O2的浓度 | 温度(℃) | 催化剂
A
5%
5
使用MnO2
B
8%
5
不使用
C
10%
40
使用MnO2
D
10%
40
不使用
|
A.A
B.B
C.C
D.D
5、选择题 把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由右图表示.在下列因素中对产生H2速率没有影响的是( )
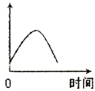
A.H+的浓度
B.镁条的表面积
C.溶液的温度
D.Cl-的浓度