1、选择题 实验室用锌粒与2mol/L硫酸溶液制取氢气,下列措施不能增大化学反应速率的是( )
A.向该硫酸溶液中加入等体积的水
B.改用3mol/L硫酸溶液
C.改用热的2mol/L硫酸溶液
D.用锌粉代替锌粒
参考答案:A、该硫酸溶液中加入等体积的水,硫酸的浓度减少,因减少反应物的浓度,反应速率减慢,故A错误;
B、因增大反应物的浓度,反应速率增大,故B正确;
C、因加热时反应体系的温度升高,则化学反应速率加快,故C正确;
D、改用铁粉,增大了铁与硫酸反应的接触面积,则反应速率加快,故D正确;
故选:A.
本题解析:
本题难度:一般
2、填空题 把在空气中久置的铝片5.0 g 投入盛有500 mL 0.5 mol ·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:
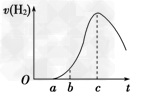
(1) 曲线由O →a段不产生氢气的原因是___________________________;有关反应的化学方程式为_________________ ;
(2) 曲线a→c段,产生氢气的速率增加较快的主要原因是____________________________;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是____________________________;
(4)该反应若使用催化剂,可使H2产量增多吗?______(填“会”或“不会”)。
参考答案:(1)硫酸首先和氧化铝反应,不产生H2;Al2O3+3H2SO4===Al2(SO4)3+3H2O
(2)反应放热,温度升高是影响反应速率的主要因素,使反应速率增大
(3)硫酸的浓度逐渐减小,该因素变为影响化学反应速率的主要因素,化学反应速率开始下降
(4)不会
本题解析:
本题难度:一般
3、选择题 在相同温度下,将H2和N2两种气体按不同比例通入相同的恒容密闭容器中,发生反应:3H2+N2 2NH3。
2NH3。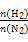 表示起始时H2和N2的物质的量之比,且起始时H2和N2的物质的量之和相等。下列图像正确的是(?)
表示起始时H2和N2的物质的量之比,且起始时H2和N2的物质的量之和相等。下列图像正确的是(?)
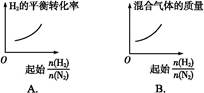
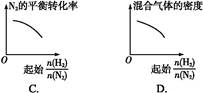
参考答案:D
本题解析:A中,随着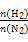 的增大,氢气含量增多,氢气的平衡转化率降低,A错误;随着
的增大,氢气含量增多,氢气的平衡转化率降低,A错误;随着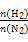 的增大,氢气含量增多,混合气体的质量减小,B错误;随着
的增大,氢气含量增多,混合气体的质量减小,B错误;随着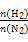 的增大,氢气含量增多,氮气的平衡转化率增大,C错误;随着
的增大,氢气含量增多,氮气的平衡转化率增大,C错误;随着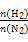 的增大,氢气含量增多,混合气体的质量减小,容器体积不变,则混合气体的密度减小,D正确。
的增大,氢气含量增多,混合气体的质量减小,容器体积不变,则混合气体的密度减小,D正确。
本题难度:一般
4、简答题 在50mL H2O2水溶液中加入2g二氧化锰,在标准状况下放出气体的体积与时间的关系如图所示:
(1)该反应还可用______代替二氧化锰作催化剂加快反应速率.
(2)A、B、C各点所表示的反应速率由快到慢的顺序为______.试解释反应速率变化的原因______.
(3)该H2O2水溶液的物质的量浓度为______.
参考答案:(1)过氧化氢分解加催化剂加快反应速率,除二氧化锰外可选择FeCl3或过氧化氢酶,故答案为:FeCl3或过氧化氢酶;
(2)图中曲线的斜率越大,反应速率越大,则反应速率由快到慢的顺序为A、B、C,因随着反应的进行,反应物浓度减小,所以反应速率减慢,
故答案为:A、B、C;随着反应的进行,反应物浓度减小;
(3)由图可知,生成氧气为56mL,n(O2)=0.056L22.4L/mol=0.0025mol,则n(H2O2)=0.0025mol×2=0.005mol,
由c=nV=0.005mol0.05L=0.1mol?L-1,故答案为:0.1mol?L-1.
本题解析:
本题难度:一般
5、选择题 可逆反应aA(g)+bB(g) cC(g)+dD(g)ΔH同时符合下列两图中各曲线的规律的( )
cC(g)+dD(g)ΔH同时符合下列两图中各曲线的规律的( )

A.a+b>c+d T1<T2 ΔH<0
B.a+b>c+d T1<T2 ΔH>0
C.a+b<c+d T1>T2 ΔH<0
D.a+b>c+d T1>T2 ΔH>0