1、选择题 有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出,据此判断它们的活动性由强到弱的顺序是
[? ]
A.d、c、a、b
B.b、a、d、c
C.d、b、a、c
D.d、a、b、c
参考答案:D
本题解析:
本题难度:一般
2、填空题 (18分)(Ⅰ)短周期元素X、Y、Z、W原子序数依次增大,X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中,请回答:
(1)X在元素周期表中的位置是 ;Y氢化物的电子式 。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈 。(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因是 。
(3)Y-AgO电池是应用广泛的鱼雷电池,其原理如图所示,该电池的负极反应式 。
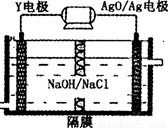
(4)由Z和W组成的化合物遇水立即水解产生两种酸,写出此反应的化学方程式 。
(Ⅱ)A、B、C分别是由H、C、O、N、Na、Cu六种元素中的两种或多种元素组成的化合物。现对A、B、C三种化合物分别做以下实验:
A是一种蓝色固体,B是无色晶体,其式量为68,C是白色固体,分别取A、B、C三种物质少量于三支试管中,加适量水溶解,发现A不溶于水,B、C都能溶于水,并且用pH试纸测定,B与C的水溶液都显碱性。
(1)取A物质少量于一支试管中,后加适量稀盐酸溶解,并用酒精灯微热,发现固体溶解时,伴有气泡产生。将56.8gA隔绝空气加热分解生成40g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96g/L)和水,生成的Y折合成标准状况下的体积为6.72L,则A的化学式为 。
(2)取B的水溶液2ml与新制Cu(OH)2混合加热,发现能出现砖红色沉淀,则物质B为 。
(3)取16.8gC固体加强热,将生成的气体依次通过经称量过的装CaCl2固体的干燥管和装足量Ba(OH)2水溶液的洗气瓶,后经再次称量发现干燥管增重1.8g,洗气瓶增重4.4g。写出C物质加入水后的溶液显碱性的原因 。(用离子方程式和必要文字解释)
参考答案:(Ⅰ)(1)第二周期第VA族 (2分)
(2)酸性 NH4++H2O NH3·H2O+H+(2分)
NH3·H2O+H+(2分)
(3)Al+4OH--3e-=AlO2-+2H2O(2分)
(4)SiCl4+3H2O=H2SiO3↓+4HCl或SiCl4+4H2O=H4SiO4↓+4HCl(2分)
(Ⅱ)(1)Cu5(OH)4(CO3)3或Cu5 C3 H4 O13(2分)
(2)HCOONa(2分)
(3)HCO3- H++CO32-、HCO3-+H2O
H++CO32-、HCO3-+H2O H2CO3+OH-;HCO3-水解程度大于电离程度(2分)
H2CO3+OH-;HCO3-水解程度大于电离程度(2分)
本题解析: (Ⅰ)通过题中条件判断X、Y、Z、W分别为N、Al 、Si、 Cl从而轻松解题,强调(3)中结合原电池原理,负极发生氧化反应,写出反应式;(4)中水解过程元素的化合价不会变化,确定产物 。(Ⅱ)A为蓝色固体,分解生成的黑色固体为氧化铜,Y已知标况下的密度,由M=p(标)·Vm,确定为CO2,结合体积求得质量为13.2g,所以 A ~ X + Y + H2O,
56.8g 40g 13.2g 3.6g 计算个元素原子个数比:Cu :C :O :H=5:3:8:4,确定A的化学式为 Cu5(OH)4(CO3)3或Cu5 C3 H4 O13;(2)B中含有醛基,且含钠元素,摩尔质量为68g/mol,确定为HCOONa;(3)通过C的性质:溶于水、且溶液显碱性,所以确定为钠盐,结合实验确定可分解,且产生等物质的量的水和二氧化碳,判断为碳酸氢钠,其溶液显示碱性的原因为:HCO3- H++CO32-、HCO3-+H2O
H++CO32-、HCO3-+H2O H2CO3+OH-;且HCO3-水解程度大于电离程度。
H2CO3+OH-;且HCO3-水解程度大于电离程度。
考点: 元素周期律、原电池电极反应式书写、物质的检验。
本题难度:困难
3、填空题 (9分)(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧热的热化学方程式是____________________________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:__________________;负极的电极反应式:_______________。
(3)下图是一个电解过程示意图。

①锌片上发生的电极反应式是:_____________________________。
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
参考答案:(1)N2H4(l)+O2(g)=N2(g)+2H2O(l) ΔH=-624 kJ·mol-1 (2分)
(2)O2+2H2O+4e-=4OH- (2分) N2H4+4OH--4e-=4H2O+N2↑ (2分)
(3)①Cu2++2e-=Cu (1分) ②112 (2分)
本题解析:(1)1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),则1molN2H4即32g在氧气中完全燃烧生成氮气和H2O,放出19.5kJ×32=624 kJ热量,因此表示N2H4燃烧热的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(l) ΔH=-624 kJ·mol-1。
(2)原电池中负极失去电子,发生氧化反应,正极得到电子发生还原反应,因此该原电池中正极反应式为O2+2H2O+4e-=4OH-,负极是肼失去电子,电极反应式为N2H4+4OH--4e-=4H2O+N2↑。
(3)①锌与电源的负极相连,作阴极,溶液中的铜离子放电,电极反应式为Cu2++2e-=Cu。
②铜片质量变化为128g,即电解128g铜时失去电子的物质的量是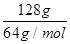 ×2=4mol,因此根据电子得失守恒可知消耗氧气的物质的量是1mol,在标准状况下的体积是22.4L,所以需要空气的体积是22.4L×5=112L。
×2=4mol,因此根据电子得失守恒可知消耗氧气的物质的量是1mol,在标准状况下的体积是22.4L,所以需要空气的体积是22.4L×5=112L。
考点:考查热化学方程式书写以及电化学原理的应用
本题难度:一般
4、填空题 如图所示装置
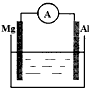
(1)若烧杯中溶液为稀硫酸,则观察到的现象为____________________________。两极反应式为:正极___________________;负极___________________。该装置将________能转化为________能。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________________,总反应方程为________________。
参考答案:(1)镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;正极:2H++2e-=H2↑;
负极:Mg-2e-=Mg2+;化学;电
(2)Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑
本题解析:
本题难度:一般
5、选择题 下列烧杯中盛放的都是稀硫酸,不能构成原电池的是( )
A.
B.
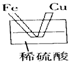
C.
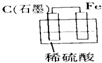
D.
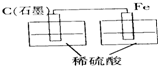
参考答案:A、B、C都符合原电池的构成条件,所以都是原电池;D装置没有形成闭合回路,所以不能构成原电池.
故选D
本题解析:
本题难度:简单