1、选择题 有两个学生在条件完全相同的情况下测定可逆反应 A2(g)?+3B2(g) C2的化学反应速率,甲测得v(A2)= 0.5?mol/(L
C2的化学反应速率,甲测得v(A2)= 0.5?mol/(L min),乙测得v(B2)=1.5?mol/(L
min),乙测得v(B2)=1.5?mol/(L min),则这两个学生的测定结果
min),则这两个学生的测定结果
[? ]
A.都正确?
B.都错误
C.甲对乙错?
D.都对或都错
参考答案:D
本题解析:
本题难度:简单
2、选择题 甲溶液的pH是4,,乙溶液的pH是5,甲溶液与乙溶液的c(H+)之比为
A. 10:1? B.1:10? C.2:1? D1:2
参考答案:A
本题解析:
pH=-log(c(H+))
甲溶液的氢离子浓度是10^-4
乙溶液的氢离子浓度是10^-5
两者之间的氢离子浓度之比c1:c2=10^-4:10^-5=10:1
本题难度:简单
3、填空题 恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g)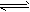 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a=__________
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。则平衡时NH3的物质的量为_____________。
(3)原混合气体与平衡混合气体的总物质的量之比为____________。
(4)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)等于_________________
参考答案:(1)a=16
(2)n (NH3)=8mol
(3)5∶4
(4)3∶3∶2
本题解析:
本题难度:一般
4、填空题 (14 分)在T1℃时,向容积为2 L 的密闭容器甲中加人1mol N1、3mol H2及少量固体催?化剂,发生反应N2(g) + 3H2(g)  2NH3(g);△H<0,10min时各物质的浓度不再变化,测得NH3 的体积分数为25% 。
2NH3(g);△H<0,10min时各物质的浓度不再变化,测得NH3 的体积分数为25% 。
(1) 该反应在0 ~l0min 时间内H2的平均反应速率为______,N2的转化率为______。
 ? (2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。
? (2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。
a.大于25%? b.等于25%? c.小于25%?
(3)右图是在T1℃时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在T2℃(T1>T2)时H2的体积分数随时间t的变化曲线。
(4)若保持T1℃,在体积也为2 L 的密闭容器乙中通入一定量的N2、H2、NH3,欲使平衡时容器乙中各物质的物质的量与容器甲中完全相同,且起始时反应向正反应方向进行,则通入H2的物质的量x的取值范围是____________。
参考答案:⑴0.06mol·L-1·min-1? (2分)? 40%? (3分)?⑵ c? (3分)
⑶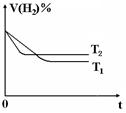 ?(3分)?⑷ 1.8mol< x <3mol? (3分)
?(3分)?⑷ 1.8mol< x <3mol? (3分)
本题解析:(1)设达平衡时,体系内生成2x mol NH3,则有: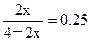 ,解得x=0.4mol,△c(H2)=0.6mol·L-1,△t=10min,故v(H2)=0.06mol·L-1 ·min-1。N2的转化率=
,解得x=0.4mol,△c(H2)=0.6mol·L-1,△t=10min,故v(H2)=0.06mol·L-1 ·min-1。N2的转化率=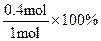 =40%。
=40%。
(2)加入0.5mol N2、1.5mol H2、0.5mol NH3相当于加入0.75mol N2、2.25mol H2,与原平衡相比,N2、H2浓度都小于原平衡,所以降低浓度导致反应物的转化率降低,达平衡时体系内NH3的体积分数小于25%。
(3)因T2>T1,所以在T2温度下反应速率更快,达平衡时间更短,但达平衡时H2的体积分数比T1时高,据此可画出对应变化曲线。
(4)甲容器中达平衡时n(H2)=1.8mol,所以x至少应大于1.8mol,要使大平衡时N2、H2、NH3浓度与甲平衡相同,则x<3mol,故有:1.8mol<x<3mol。
本题难度:一般
5、选择题 I2在KI溶液中存在下列平衡:I2(aq) + I一(aq) 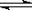 I3一(aq)。测得不同温度下该反应的平衡常数值如下表:
I3一(aq)。测得不同温度下该反应的平衡常数值如下表:
t/℃
| 5
| 15
| 25
| 35
| 50
|
K
| 1100
| 841
| 680
| 533
| 409
|
下列说法正确的是
A.反应I2(aq)+I一(aq) 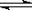 I3-(aq)的△H>0
I3-(aq)的△H>0
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述体系中加入苯,平衡不移动
D.25℃时,向溶液中加入少量KI固体,平衡常数K小于680
参考答案:B
本题解析:略
本题难度:一般