1、选择题 从下列事实,不能用勒夏特列原理解释的是?(? )
A.在溴水中存在如下平衡:Br2+H2O  HBr+HBrO当加入NaOH溶液后颜色变浅
HBr+HBrO当加入NaOH溶液后颜色变浅
B.对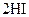

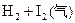 平衡体系增加压强使颜色变深
平衡体系增加压强使颜色变深
C.反应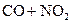
 CO2+NO△H<0升高温度使平衡向逆方向移动
CO2+NO△H<0升高温度使平衡向逆方向移动
D.合成氨反应:

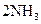 ,△H<0 为使氨的产率提高,理论上应采取低温高压的措施
,△H<0 为使氨的产率提高,理论上应采取低温高压的措施
2、填空题 (8分)450K时下列起始体积相同的密闭容器中充入2mol SO2、1mol O2,其反应是2SO2(g)+O2(g) 2SO3(g);
2SO3(g);
△H=-96.56kJ/mol,△S=-190 J?mol-1?K-1。
甲容器在反应过程中保持压强不变,乙容器保
持体积不变,丙容器维持绝热,三容器各自建
立化学平衡。

(1)平衡常数:K (甲)?K (乙)?_?K(丙) (填“>”、“<”或“=”)。
(2)达到平衡时SO2的转化率:α(甲) _?α(乙)? _ α(丙)(填“>”、“<”或“=”)。
(3)达到平衡后,若向甲、乙两容器中分别通入少量且等量Ar气体, 甲容器的化学平衡________移动,乙容器的化学平衡_________移动。(填“正向”、“逆向” 或“不”)
(4)通过计算确定5000C时正反应? ____?(填“能” 或“不能”)自发进行。
3、选择题 在1L容器中含有2amolH2和2amolN2,设法使其反应并达到平衡,测得N2的转化率 为20%,此时H2的浓度是
为20%,此时H2的浓度是
A. 0.4amol·L-1
0.4amol·L-1
B.0.8amol·L-1
C.1.6a mol·L-1
D.1.8a mo l·L-1
l·L-1
4、选择题 已知某可逆反应,x A(g) y B(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器体积扩大到原来的两倍,再达到平衡时,测得A的浓度为0.3 mol/L。下列判断正确的是
y B(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器体积扩大到原来的两倍,再达到平衡时,测得A的浓度为0.3 mol/L。下列判断正确的是
A.x < y
B.平衡向正反应方向进行
C.B的体积分数降低
D.缩小体积、增大压强,A的体积分数增大
5、填空题 能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ.CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=+206.0 kJ/mol
Ⅱ.CO(g)+2H2(g)=CH3OH(g)ΔH=-129.0 kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为_____。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如图。
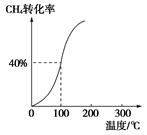
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________;
②100 ℃时反应Ⅰ的平衡常数为________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将1.0 mol CO与2.0 mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的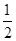 ,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
A.c(H2)减小
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡时 减小
减小
 CO(g)+2H2(g),此反应能自发进行的原因是:___。
CO(g)+2H2(g),此反应能自发进行的原因是:___。