1、选择题 0.1mol/L的NH4Cl溶液中,离子浓度大小排列正确的是
A.c(Cl-)> c(NH4+)> c(OH-)> c(H+)
B.c(NH4+)> c(Cl-)> c(OH-)> c(H+)
C.c(Cl-)> c(NH4+)> c(H+)> c(OH-)
D.c(NH4+)> c(Cl-)> c(H+)> c(OH-)
参考答案:C
本题解析:NH4Cl溶液中的部分水解:c(Cl-)> c(NH4+),且两离子为主要离子,溶解呈酸性, c(H+)> c(OH-),故C正确
本题难度:简单
2、选择题 常温下测得NaA盐溶液的PH值是10,有关盐NaA的说法正确的是
A.强酸弱碱盐
B.强碱弱酸盐
C.强酸强碱盐
D.弱酸弱碱盐
参考答案:B
本题解析:该溶液水解呈碱性,水解时谁强显谁性;故为强碱弱酸盐。
本题难度:困难
3、填空题 (10分)在KClO3+6 H Cl(浓)=KCl+3Cl2↑+3H2O的反应中,氧化剂是___________,还原产物是_________,得电子与失电子个数比是____________,氧化产物与还原产物的质量比是________,试标出反应电子转移方向和数目_________________________
参考答案:
KClO3,Cl2, 1∶5, 5∶1, 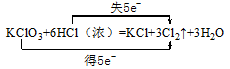
本题解析:该反应中元素的化合价变化如下:KClO3→Cl2 ,氯元素由+5价→0价,,5个电子,被还原,所以KClO3是氧化剂,Cl2是还原产物;H Cl→Cl2,氯元素化合价由-1价→0价,失1个电子,氯元素被氧化,Cl2是氧化产物,根据得失电子守恒,可知得电子与失电子个数比是1∶5,氧化产物与还原产物的质量比是5:1,1moL氯酸钾转移的电子的物质的量是5moL,再根据原子守恒配平方程式.答案为:
KClO3,Cl2, 1∶5, 5∶1, 
考点:考查氧化还原反应的基本概念与电子转移。
本题难度:一般
4、选择题 对于反应Br2+SO2+2H2O=2HBr+H2SO4和2HBr+H2SO4(浓)=Br2+SO2↑+2H2O,下列说法中正确的是
A.氧化性:浓H2SO4>Br2,还原性:SO2B.它们互为可逆反应
C.反应条件的改变引起了反应方向的改变,它们都符合事实
D.它们相互矛盾,不可能符合事实
参考答案:C
本题解析:
本题难度:困难
5、选择题 某溶液中由水电离出来的C(OH—)=10-12mol/L,则该溶液中的溶质不可能是
A.HCl
B.NaOH
C.NH4Cl
D.H2SO4
参考答案:C
本题解析:由水电离反应式知:此溶液水电离产生的C(H+)=C(OH—) =10-12mol/L,若溶液中的H+全部来自水的电离,则此溶液显碱性,是因溶有碱类物质所致,若溶液中的H+不仅为水电离所产生,则此溶液显酸性,为酸性物质电离所致。NH4Cl不可能电离产生H+。
本题难度:简单