1、选择题 将2×10- 5mol/LKCl 与2×10- 5mol/LAgNO3溶液等体积混合,下列说法正确的是 (已知AgCl 的Ksp=1.8×10-10 )
A.有AgCl沉淀析出
B.无AgCl沉淀析出
C.无法确定有无AgCl沉淀析出
D.有沉淀但不是AgCl
参考答案:B
本题解析:将2×10- 5mol/LKCl 与2×10- 5mol/LAgNO3溶液等体积混合,溶液中氯离子和银离子的浓度分别都是1×10- 5mol/L,此时c(Ag+)·c(Cl-)=1×10-10<1.8×10-10 ,所以没有沉淀析出,答案选B。
点评:该题是基础性试题的考查,也是高考中的重要考点。试题基础性强,紧扣教材基础,有利于巩固学生的基础,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确溶度积常数的含义,然后结合题意灵活运用即可。
本题难度:简单
2、填空题 重金属离子(Cu2+、Hg2+、Cd2+、Pb2+等)是常见的有毒污染物,水体、土壤及生物一旦受到重金属离子的污染就很难去除,重金属污染给生态环境和人类自身造成严重危害.某公司以含重金属的废水为原水,处理废水工艺流程如图1所示:

已知下列物质的Ksp:
| Cu(OH)2 | CuS | FeS | PbS | HgS | CdS
2.2×10-20
8.5×10-45
6.3×10-18
3.4×10-28
4×10-53
8×10-29
|
请回答下列问题:
(1)OH-与S2-相比,除去废水中的Cu2+效果较好的是______.
(2)图2为某些重金属离子在不同温度与pH下的平衡浓度:
从图中分析,除去废水中的重金属离子的最佳温度为______,上述流程中NaOH的作用是调节溶液的PH为______.
参考答案:(1)由表中数据可知Ksp(CuS)<<Ksp[Cu(OH)2],所以CuS在水中溶解度比Cu(OH)2小,所以OH-与S2-相比,除去废水中的Cu2+效果较好的是S2-;
故答案为:S2-;
(2)由图中数据可知在60℃左右时重金属离子的浓度最低,所以除去废水中的重金属离子的最佳温度为:60℃;由图中数据可知PH在8.8~9.0时重金属离子浓度最低,所以NaOH的作用是调节溶液的PH为8.8~9.0;
故答案为:60℃;调节溶液的PH为8.8~9.0.
本题解析:
本题难度:一般
3、简答题 (1)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5?mol?L-1.若忽略水的电离及H2CO3的第二级电离,请计算可逆反应H2CO3

HCO3-+H+的平衡常数K1.(已知10-5.60=2.5×10-6)
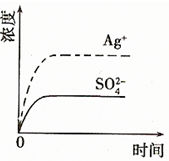
(2)已知Ag2SO4的Ksp?为2.0×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034mol?L-1).若t1时刻在上述体系中加入100mL?0.020mol?L-1?Na2SO4?溶液,请通过计算说明该溶液中是否有沉淀析出?(写出计算过程,忽略体积变化)
下列示意图中,能正确表示t1时刻后Ag+和SO32-浓度随时间变化关系的是______

参考答案:(1)根据平衡常数K1=c(H+)?c(HCO3-)c(H2CO3),
c(H+)=c(HCO3-)=2.5×10-6mol/L,
c(H2CO3)=1.5×10-5 mol L,
可求 出 K1=4.2×10-7,答:可逆反应H2CO3

HCO3-+H+的平衡常数K1为4.2×10-7;
(2)Ag2SO4刚好为100ml的饱和溶液,因为c(Ag+)=0.034mol?L-1,所以c(SO42-)=0.017mol?L-1;
当加入100ml 0.020mol?L-1Na2SO4溶液后,c(SO42-)=0.0185mol?L-1,c(Ag+)=0.017mol?L-1,
由此可以看出应为B图象,
此时Q<Ksp,则该溶液中没有沉淀析出,
故答案为:B.
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
A.难溶电解质的溶度积越小,溶解度越大
B.可以通过沉淀反应使杂质离子浓度为0
C.难溶电解质的溶解平衡是一种静态平衡
D.一定浓度的NH4Cl溶液可以溶解Mg(OH)2
参考答案:D
本题解析:A不正确,难溶电解质的溶度积越小,溶解度越小。B不正确,绝地不溶的物质是不存在的。C不正确,.难溶电解质的溶解平衡是一种动态平衡。氯化铵能结合氢氧化镁电离出的OH-,生成难电离的氨水,所以能溶解氢氧化镁,D正确,答案选D。
本题难度:一般
5、选择题 在含有浓度均为0.01mol?L-1的Cl-、Br-、I-离子的溶液中,缓慢加入AgNO3稀溶液,析出三种沉淀的先后顺序是(?)
A.AgCl、AgBr、AgI
B.AgI、AgBr、AgCl
C.AgBr、AgCl、AgI
D.三种沉淀同时析出
参考答案:B
本题解析:由于AgCl、AgBr、AgI的溶解度逐渐减小,所以首先产生的沉淀是AgI,其次是AgBr,最后是AgCl,答案选B。
本题难度:一般