1、填空题 二硫化亚铁是Li/FeS2电池的正极活性物质,可用水热法合成。FeSO4、Na2S2O3、S及H2O在200 ℃连续反应24 h,四种物质以等物质的量反应,再依次用CS2、H2O洗涤、干燥及晶化后得到。
(1)合成FeS2的离子方程式为_____________________________________。
(2)用水洗涤时,如何证明SO42—已除尽?________________________________________。
(3)已知1.20 g FeS2在O2中完全燃烧生成Fe2O3和SO2气体放出8.52 kJ热量,FeS2燃烧反应的热化学方程式为__________________________。
(4)取上述制得的正极材料1.120 0 g(假定只含FeS一种杂质),在足量的氧气流中充分加热,最后得0.800 0 g红棕色固体,试计算该正极材料中FeS2的质量分数(写出计算过程)。
参考答案:(1)Fe2++S2O32—+S+H2O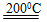 FeS2+2H++SO42—
FeS2+2H++SO42—
(2)取少许最后一次洗涤滤液,先用足量盐酸酸化,再向上述清液中滴加BaCl2溶液,若不出现白色浑浊,表示已洗涤干净
(3)4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)? ΔH=-3 408 kJ·mol-1
[或FeS2(s)+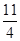 O2(g)=
O2(g)=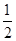 Fe2O3(s)+2SO2(g)]? ΔH=-852 kJ·mol-1
Fe2O3(s)+2SO2(g)]? ΔH=-852 kJ·mol-1
(4)解:120n(FeS2)+88n(FeS)=1.120 0
n(FeS2)+n(FeS)=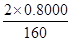
n(FeS2)=0.007 5 mol
w(FeS2)=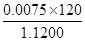 ≈0.803 6
≈0.803 6
本题解析:(1)由题中信息可写出四种反应物,再由原子守恒和电荷守恒写出产物,Na2S2O3中一个S显+6价,一个S显-2价,其中-2的S与单质S发生归中反应,根据得失电子守恒配出反应。(2)检验SO42—,需要先用盐酸除去干扰离子,以防生成除BaSO4以外的钡盐沉淀。(3)0.01 mol FeS2完全燃烧放出8.52 kJ的热量。写热化学方程式要标注物质的状态,同时ΔH应与化学计量系数成比例。(4)由质量关系,列出120n(FeS2)+88n(FeS)=1.120 0,由铁原子守恒列出n(FeS2)+n(FeS)=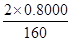 mol,联合解得FeS2的物质的量,进而求出其含量。
mol,联合解得FeS2的物质的量,进而求出其含量。
本题难度:一般
2、选择题 下列物质中,含有氧原子的物质的量最大的是
[? ]
A. 6.02×1023个O2
B. 0.6 mol H2SO4
C. 2.1mol H2O
D. 1.204×1024个CO
参考答案:B
本题解析:
本题难度:简单
3、计算题 (11分)t ℃,22.0%的NaNO3(aq) 150 mL,加100 g水稀释后浓度变为14.0%,求原溶液的物质的量浓度。
参考答案:13.9 mol·L-1
本题解析:设原溶液质量m g,则有:
m×22%=(m+100)×14%
m="175" (g)
c(NaNO3)=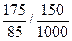
="13.9" mol·L-1
本题难度:简单
4、选择题 1molSO2和1molSO3具有相同的:①分子数;②原子数;③S原子数;④O原子数
A.①②
B.①③
C.①④
D.②④
参考答案:B
本题解析:SO2与SO3分子含有S相同的原子数、不同的O原子数,所以1molSO2和1molSO3具有相同的分子数和S原子数,原子数和O原子数不同,故B项正确。
本题难度:一般
5、选择题 欲用浓硫酸配制450mL0.50mol/L的硫酸溶液.下列说法正确的是( )
A.主要玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶
B.定容时俯视容量瓶的刻度线会导致所配制的溶液浓度偏低
C.量取浓硫酸后用蒸馏水把量筒洗涤2至3次,然后把洗涤液倒入容量瓶导致所配制的溶液浓度偏高
D.摇匀后,发现液面低于容量瓶刻度线后继续加水至凹液面与刻度线相切导致所配制的溶液浓度偏高
参考答案:A.实验室没有450mL容量瓶,需要选用500mL容量瓶,故A错误;
B.定容时俯视容量瓶体积偏小,浓度偏大,故B错误;
C.量筒不需要洗涤,洗涤会使溶质的物质的量增大,浓度偏高,故C正确;
D.继续加水至凹液面与刻度线相切,使溶液体积偏大,浓度偏小,故D错误.
故选C.
本题解析:
本题难度:一般