1、选择题 下列关于ⅦA 族元素的叙述正确的是
[? ]
A.ⅦA 族元素是同周期中原子半径最大的元素
B.ⅦA 族元素是同周期中非金属性最弱的元素
C.ⅦA 族元素的最高正价都是+7 价
D.ⅦA 族元素其简单阴离子的核外电子层数等于该元素所在的周期数
参考答案:D
本题解析:
本题难度:简单
2、推断题 现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96gD的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。
(1)写出元素符号:A__________,C___________,E____________。
(2)B、D的最高价氧化物对应水化物相互反应的离子方程式为:_________________________。
(3)用电子式表示C与E形成E2C的过程:__________________________。
参考答案:(1)H;S;K
(2)Al(OH)3+OH-==AlO2-+2H2O
(3)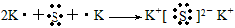
本题解析:
本题难度:一般
3、选择题 下列事实能说明氯元素的非金属性比硫元素强的是( )
①还原性:Cl-<S2-
②Cl2能与H2S反应生成S
③HClO4的酸性比H2SO4的强
④常温下Cl2是气体,S是固体.
A.①②③
B.①②④
C.①③④
D.②③④
参考答案:①还原性:Cl-<S2-,则非金属性Cl>S,能说明氯元素的非金属性比硫元素强;
②Cl2能与H2S反应生成S,则非金属性Cl>S,能说明氯元素的非金属性比硫元素强;
③HClO4的酸性比H2SO4的强,则非金属性Cl>S,能说明氯元素的非金属性比硫元素强;
④常温下Cl2是气体,S是固体,为物理性质,不能比较非金属性,
故选A.
本题解析:
本题难度:一般
4、推断题 已知X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离子,甲、乙、丙均是由上述四种离子中的两种组成的化合物。甲、乙、丙溶于水所得溶液分别呈酸性、碱性和中性。
(1)通常状况下,Z的单质是一种黄绿色气体,工业上常用电解丙的溶液的方法制备该单质,制备反应的化学方程式是_________________;
(2)甲的化学式是________,乙的化学式可能是________;若将甲的溶液与乙的溶液混合产生沉淀和气体,则反应的离子方程式是________________;
(3)Y单质可用来制造Y--空气燃料电池,该电池通常以氢氧化钾溶液为电解质溶液,则正极反应式为
________________ 。
参考答案:(1)2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(2)AlCl3;Na2O、Na2S;2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
(3)O2+2H2O+4e-==4OH-
本题解析:
本题难度:一般
5、选择题 下列描述的元素中,一定属于主族元素的有
[? ]
A.元素的原子最外层电子个数为2
B.元素的原子最外层电子个数为6
C.位于元素周期表中ⅡA族右边的元素
D.阴离子RO4-中R元素
参考答案:B
本题解析:
本题难度:一般