1、选择题 下列物质与其用途相符合的是
①ClO2-消毒剂?
②NaHCO3-治疗胃酸过多?
③明矾-做干燥剂
④硅胶-做净水剂?
⑤Na2O2-呼吸面具的供氧剂?
⑥NaClO-漂白纺织物.
A.②④⑤⑥
B.①②⑤⑥
C.①②④⑤
D.全部
参考答案:B
本题解析:分析:①根据ClO2具有强氧化性分析;
②NaHCO3可与盐酸反应;
③明矾不具有吸水性;
④硅胶具有吸水性;
⑤Na2O2与二氧化碳反应生成氧气;
⑥NaClO可生成具有漂白性的HClO.
解答:①ClO2具有强氧化性,可做消毒剂,故①正确;
②胃酸的主要成分为盐酸,NaHCO3可与盐酸反应而治疗胃酸过多.故②正确;
③明矾不具有吸水性,不作干燥剂,但可作净水剂,故③错误;
④硅胶具有吸水性,可用作干燥剂,不能用作净水剂,故④错误;
⑤Na2O2与二氧化碳反应生成氧气,则可用作呼吸面具的供氧剂,故⑤正确;
⑥NaClO可生成具有漂白性的HClO,可用于漂白,故⑥正确.
故选B.
点评:本题考查常见物质的性质和用途,题目难度不大,本题注意物质的性质决定用途,学习中注意相关基础知识的积累.
本题难度:困难
2、选择题 下列物质中,既能与盐酸反应又能与氢氧化钠溶液反应的是
A.(NH4)2SO4
B.Al(OH)3
C.Na2SO4
D.Mg(NO3)2
参考答案:B
本题解析:分析:既能与盐酸反应又能与氢氧化钠溶液反应的物质有:两性化合物(如Al2O3、Al(OH)3等)、弱酸的铵盐(如(NH4)2CO3等)、弱酸的酸式盐(NaHCO3、NaHS等)、单质(如Al)、氨基酸等.(NH4)2SO4与氢氧化钠溶液反应,不与盐酸反应;Na2SO4不与盐酸和氢氧化钠溶液反应;Mg(NO3)2和氢氧化钠溶液反应,不与盐酸反应.
解答:A、(NH4)2SO4与氢氧化钠溶液反应,是强碱制弱碱,不与盐酸反应,故A错误;
B、Al(OH)3是两性氢氧化物溶于强酸强碱,故B正确;
C、Na2SO4是强酸强碱盐,不与盐酸和氢氧化钠溶液反应,故C错误;
D、Mg(NO3)2和氢氧化钠溶液反应生成氢氧化镁沉淀,不与盐酸反应,故D错误;
故选B.
点评:本题考查物质与强酸强碱反应的性质,盐类、两性化合物与强酸强碱反应遵循的复分解反应规律.
本题难度:困难
3、选择题 下下列变化中钠元素发生还原反应的是
A.Na→Na2O2
B.Na2O→NaOH
C.NaCl→Na
D.NaCl→NaHSO4
参考答案:C
本题解析:钠元素发生还原反应即是化合价降低的反应。
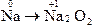 ;
;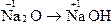
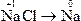 ;
;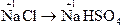
只有C选项中Na元素化合价降低。
本题难度:简单
4、选择题 将下表中的Y物质加入或通入X物质中反应,所得溶液中一定只含一种溶质的是
A.A
B.B
C.C
D.D
参考答案:B
本题解析:分析:A.少量的二氧化碳和氢氧化钠溶液反应生成碳酸钠,过量的二氧化碳和氢氧化钠溶液反应生成碳酸氢钠;
B.钠和水反应生成氢氧化钠;
C.氯气和氢氧化钙溶液反应生成氯化钙、次氯酸钙;
D.当氢氧化钡不足量时,生成硫酸钡和氢氧化铝,当氢氧化钡过量时生成硫酸钡和偏铝酸钠.
解答:A.少量的二氧化碳和氢氧化钠溶液反应生成碳酸钠,溶液中的溶质是碳酸钠和氢氧化钠,过量的二氧化碳和氢氧化钠溶液反应生成碳酸氢钠,溶液中的溶质是碳酸氢钠,故A错误;
B.无论钠的量多少,钠和水反应都生成氢氧化钠和氢气,溶液中的溶质都是氢氧化钠,故B正确;
C.氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,溶液中的溶质含有多种,故C错误;
D.当氢氧化钡不足量时,生成硫酸钡和氢氧化铝,溶液中的溶质是硫酸铝,当氢氧化钡过量时生成硫酸钡和偏铝酸钠,溶液中的溶质是偏铝酸钠和氢氧化钡,故D错误;
故选B.
点评:本题考查物质之间的反应,明确物质的性质是解本题关键,注意有些反应与物质的量的多少有关,物质的量不同,反应不同,为易错点
本题难度:困难
5、选择题 30mL0.05mol/LNa2SO3溶液恰好与50mL0.02mol/LKXO4溶液完全反应转化为Na2SO4.则X元素在产物中的化合价是
A.+2
B.+3
C.+4
D.+5
参考答案:C
本题解析:分析:Na2SO3被氧化为Na2SO4,S元素化合价由+4价升高为+6价;KXO4中X元素发生还原反应,令X元素在产物中的化合价为a价,根据电子转移守恒计算a的值.
解答:令X元素在产物中的化合价为a价,根据电子转移守恒,则:
30×10-3L×0.05mol/L×(6-4)=50×10-3L×0.02mol/L×(7-a)
解得a=+4
故选:C.
点评:考查氧化还原反应计算、氧化还原反应概念等,难度中等,表示出得失数目是解题关键.熟练掌握电子转移守恒思想的运用.
本题难度:一般