1、选择题 将pH为5的硫酸溶液稀释500倍,稀释后溶液中c (SO42-):c (H+)约为
A.1:1
B.1:2
C.1:10
D.10:1
参考答案:C
本题解析:当无限稀释时就要考虑水的电离平衡,即无限稀释时溶液中的氢离子浓度接近10-7mol/L。pH为5的硫酸溶液的浓度是5×10-6mol/L,所以稀释500倍后,c (SO42-)=1×10-8mol/L,所以稀释后溶液中c (SO42-):c (H+)约为1︰10,答案选C。
本题难度:一般
2、选择题 常温下,用 0.1000 mol·L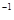 NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L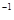
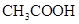 溶液所得滴定曲线如下图。下列说法正确的是
溶液所得滴定曲线如下图。下列说法正确的是

A.点①所示溶液中: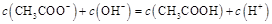
B.点②所示溶液中: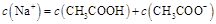
C.点③所示溶液中: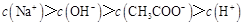
D.滴定过程中可能出现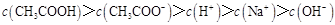
参考答案:D
本题解析:点①所示溶液中,醋酸是过量的,溶液显酸性。溶液是由等量的醋酸和醋酸钠混合而成的。由于醋酸的电离程度大于醋酸钠的水解程度,所以 。根据电荷守恒可判断
。根据电荷守恒可判断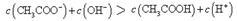 ,选项A是不正确的。点②所示溶液显中性,此时醋酸是过量的,所以
,选项A是不正确的。点②所示溶液显中性,此时醋酸是过量的,所以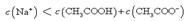 ,B不正确。点③所示溶液中,醋酸和氢氧化钠恰好反应,生成的盐水解显碱性,所以
,B不正确。点③所示溶液中,醋酸和氢氧化钠恰好反应,生成的盐水解显碱性,所以 ,C不正确。当加入的氢氧化钠很少时,D是有可能正确的,所以答案是D。
,C不正确。当加入的氢氧化钠很少时,D是有可能正确的,所以答案是D。
本题难度:一般
3、选择题 人体胃液中含有一定浓度的盐酸,若大量喝水,则胃液的pH与所喝入水的体积(V)关系曲线表达正确的是(? )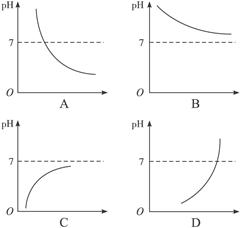
参考答案:C
本题解析:喝入水后盐酸被稀释,c(H+)减小,pH变大。但稀释后仍是酸,故pH<7。
本题难度:一般
4、选择题 下列说法正确的是
A.0.1mol/L的氨水和0.1mol/L的硝酸等体积混合,充分反应后所得溶液中:
c(NO3﹣)>c(NH4+)>c(OH﹣)>c(H+)
B.0.1mol/L的醋酸溶液中:c(H+)=c(CH3COO﹣)
C.将氨气通入一定量硫酸溶液中,充分反应后溶液pH=7则;c(NH4+)>c(SO42-)
D.0.1mol/L的硫化钠溶液中:c (Na+)=2c(S2-)+c(HS-)+c(H2S)
参考答案:C
本题解析:
正确答案:C
A.不正确,0.1mol/L的氨水和0.1mol/L的硝酸等体积混合,充分反应后所得溶液相当于NH4NO3,溶液呈酸性:? c(NO3﹣)>c(NH4+)>c(H+)>c(OH﹣)
B.不正确,0.1mol/L的醋酸溶液中:c(H+)=c(CH3COO﹣)+c(OH― )
C.?正确,将氨气通入一定量硫酸溶液中,充分反应后溶液pH=7则;电荷守恒,c(NH4+)+c(H+)= 2c(SO42-)+c(OH― ),当溶液呈中性时,c(NH4+)= 2c(SO42-),所以c(NH4+)>c(SO42-)
D.不正确,0.1mol/L的硫化钠溶液中存在物料守恒:c (Na+)=2c(S2-)+2c(HS-)+2c(H2S)
本题难度:一般
5、选择题 反应:H2S(g)+aO2(g)
参考答案:
本题解析:
本题难度:一般