1、选择题 下列各组中两个化学反应,属于同一反应类型的一组是
A.由苯制溴苯;由乙醇与乙酸反应制乙酸乙酯
B.由乙烯制1
C.2-二溴乙烷;由乙烷制一氯乙烷
D.乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色
E.由苯制硝基苯;由苯制环己烷
参考答案:A
本题解析:A中都是取代反应,B中前者是加成反应,后者是取代反应。C中前者是加成反应,后者是氧化反应。D中前者是取代反应,后者是加成反应。所以答案选A。
本题难度:一般
2、选择题 下列各组物质不属于同分异构体的是
A.葡萄糖和果糖
B.淀粉和纤维素
C.蔗糖和麦芽糖
D.正戊烷和新戊烷
参考答案:B
本题解析:试题分析:分子式相同结构不同的化合物互为同分异构体,据此可知选项ACDC中都是互为同分异构体的。B中二者都是高分子化合物,属于混合物,不能互为同分异构体,答案选B。
考点:考查同分异构体的判断
点评:该题是高考中的常见考点,主要是考查学生对同分异构体含义以及判断依据的熟悉了解程度,有利于培养学生的逻辑推理能力。该题难度不大,记住含义和判断标准,灵活运用即可。
本题难度:简单
3、选择题 化学反应SO2+H2O+HNO3-H2SO4+NO经配平后,还原剂的化学计量数为
A.1
B.2
C.3
D.4
参考答案:C
本题解析:分析:根据氧化还原反应得失电子数相等配平方程式.
解答:SO2+H2O+HNO3-H2SO4+NO,该反应中化合价的变化如下:SO2→H2SO4,S元素由+4价→+6价,一个SO2分子失2个电子,所以SO2是还原剂;HNO3→NO,N元素由+5价→+2价,一个HNO3分子得3个电子,所以硝酸是氧化剂;得失电子的最小公倍数为6,所以SO2的化学计量数为3,HNO3的化学计量数为2,其它元素根据原子守恒配平.所以该方程式为
3SO2+2H2O+2HNO3=3H2SO4+2NO.
故选C.
点评:本题考查了氧化还原反应方程式的配平,氧化剂、还原剂根据得失电子数相等配平,其它元素根据原子守恒配平.
本题难度:一般
4、选择题 与3-甲基-1-戊烯同属烯烃且主链为4个碳的同分异构体共有
A.3种
B.4种
C.5种
D.6种
参考答案:B
本题解析:可参见下面的碳链图示:
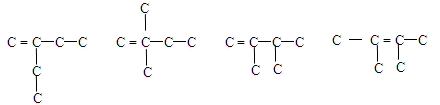
本题难度:困难
5、选择题 下列海水综合利用的过程中,可不涉及化学变化的是
A.海水制淡水
B.海水制纯NaCl
C.海水制镁
D.海水制溴
参考答案:A
本题解析:分析:判断一个变化是物理变化还是化学变化,要依据在原子核不变的情况下,变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成其他物质的是物理变化.
解答:A、海水通过蒸馏制淡水,蒸馏是根据物质沸点的不同来实现物质分离的方法,没有新物质生成,是物理变化,故A正确;
B、海水制纯NaCl,粗盐中含有的SO42-、Ca2+、Mg2+等杂质,加入氯化钡、碳酸钠、氢氧化钠来除去,是化学变化,故B错误;
C、通过电解熔融的氯化镁即得镁,是化学变化,故C错误;
D、通过氯气将溴离子和碘离子氧化为溴单质和碘单质,是化学变化,故D错误;
故选A.
点评:本题借助物质的制备考查了化学变化和物理变化,难度不大,掌握物质的制备和判断化学反应的方法是解题的关键.
本题难度:一般