1、选择题 在某无色强酸性溶液中,下列各组离子一定能大量共存的是( )
A.N
、Fe3+、C1O-、SCN-
B.Mg2+、Cu2+、S、N
C.Na+、K+、N、S
D.K+、A13+、C、C1-
参考答案:A.Fe3+有颜色,不能大量共存,故A错误;
B.Cu2+有颜色,不能大量共存,故B错误;
C.溶液无色,且离子之间不发生任何反应,可大量共存,故C正确;
D.酸性条件下CO32-不能大量共存,故D错误.
故选C.
本题解析:
本题难度:简单
2、选择题 在某无色透明溶液中加入铝粉能放出H2,下列各组离子在该溶液中有可能共存的是
[? ]
A、Cu2+、OH-、SO42-
B、NH4+、Cl-、SO42-
C、Ca2+、H+、SO42-
D、K+、Ba2+、HCO3-
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列事实能用同一原理解释的是
[? ]
A.SO2、Cl2均能使品红溶液褪色?
B.NH4HCO3晶体、固体I2受热均能变成气体
C.S与Fe、Cu反应均生成低价硫化物?
D.ClO-与S2-或H+均不能共存
参考答案:C
本题解析:
本题难度:简单
4、选择题 从下列事实所得出的结论或给出的解释正确的是
?
| 实验事实
| 结论或解释
|
A
| 将40 g NaOH溶于1 L蒸馏水中
| 该溶液的物质的量浓度为1mol﹒L-1
|
B
| 0.1 mol/L CH3COOH溶液在稀释过程中
| 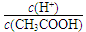 ?将变小 ?将变小
|
C
| 酸H2X为弱酸
| 常温下,盐NaHX溶液pH一定大于7
|
D
| 在溶液的稀释过程中
| 离子浓度:有的可能增大,有的可能减小,有的可能不变
参考答案:D
本题解析:A不正确,因为不能确定溶液的体积;醋酸是弱电解质,稀释促进电离。则稀释过程中氢离子的物质的量增加,醋酸分子的物质的量减少,所以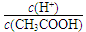 将变大,B不正确;C不正确,如果HX-的电离程度大于水解程度,溶液显酸性;因此正确的答案选D。 将变大,B不正确;C不正确,如果HX-的电离程度大于水解程度,溶液显酸性;因此正确的答案选D。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生的学习效率和应试能力。
本题难度:一般
5、选择题 下列离子方程式正确的是
A.向CuSO4溶液中投入Na: Cu2++ 2Na= Cu+ 2Na+
B.向FeCl3溶液中滴加KSCN溶液: Fe3+ + 3SCN- = Fe(SCN)3↓
C.向NaHCO3溶液中加过量Ca(OH)2溶液:Ca2+ + HCO3- + OH- = CaCO3↓ + H2O
D.向BaCO3固体中加入过量的稀H2SO4:BaCO3 + 2H+= Ba2+ + CO2↑ + H2O
|
参考答案:C
本题解析:A.由于Na活动性很强,所以把Na会先与溶液中的水发生置换反应,错误;B.向FeCl3溶液中滴加KSCN溶液,发生离子反应Fe3+ + 3SCN- = Fe(SCN)3,产生的是可溶性弱电解质,不是沉淀,错误;C.向NaHCO3溶液中加过量Ca(OH)2溶液,不足量的NaHCO3完全反应,以NaHCO3为标准,离子方程式是:Ca2+ + HCO3- + OH- = CaCO3↓ + H2O,正确;D.向BaCO3固体中加入过量的稀H2SO4,产生的BaSO4是沉淀,离子方程式是:BaCO3 + 2H+ +SO42-= BaSO4+ CO2↑ + H2O,错误。
考点:考查离子方程式的正误判断的知识。
本题难度:一般