1、选择题 改变下列哪个条件,一定会引起平衡的移动
A.温度
B.浓度
C.压强
D.催化剂
参考答案:A
本题解析:试题分析:催化剂只影响化学反应速率,不一定引起平衡的移动;当一个反应的前后化学计量数之和相等时,压强也不一定引起平衡的移动;当反应中各物质的浓度均按照化学计量数变化时,也不一定引起平衡的移动;故B、C、D选项错误;当温度改变时,反应的平衡常数改变,化学反应重新达到新的状态,一定会引起平衡的移动。故A项正确。
考点:影响化学平衡的因素。
点评:此题可以先排除催化剂,而浓度和压强,对于特殊的反应,平衡不移动,利用了等效平衡的原理。
本题难度:困难
2、选择题 可逆反应H2(g)+ I2(g) 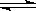 2HI(g)达到平衡时的标志是(? )
2HI(g)达到平衡时的标志是(? )
A.H2、I2、HI的浓度相等
B.1个I—I键断裂的同时,有2个H—I键断裂
C.混合气体的质量不再改变
D.混合气体密度恒定不变
参考答案:B
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,A不能说明。B中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。根据质量守恒定律可知,C中的关系始终是成立,不正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,D不正确,因此答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。
本题难度:一般
3、选择题 某温度下,可逆反应mA(g)+nB(g) pC(g)+qD(g)平衡常数为K,下列说法正确的是(? )
pC(g)+qD(g)平衡常数为K,下列说法正确的是(? )
A.K越大,达到平衡时,反应进行的程度越大
B.K随着温度的升高而增大
C.K越小,达到平衡时,反应物的转化率越大
D.K随反应物浓度的改变而改变
参考答案:A
本题解析:K的意义就是反应进行的程度,K值越大,反应进行的程度越大,A对;只有正反应为吸热反应,K才随着温度的升高而增大,因为该反应是吸热还是放热反应不清楚,B错;K值越大,反应物的转化率越大,C错;K只与温度有关,与反应物的浓度无关,D错。
本题难度:一般
4、选择题 甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应: 。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如下图表所示:
。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如下图表所示:

下列说法正确的是
A.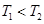 ,且该反应为吸热反应
,且该反应为吸热反应
B.x=2
C.若平衡后保持温度不变,改变容器体积平衡不移动
D.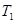 ℃下,若起始时向甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
℃下,若起始时向甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
参考答案:C
本题解析:A.对于甲、乙来说,起始投入量相同,而反应乙首先达到平衡说明温度T2>T1。在平衡时C(C)(乙) <C(C)(甲),说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热方向移动,逆反应方向是吸热反应,所以正反应是放热反应。错误。B.对乙、丙来说,反应的温度相同,而起始投入量丙是乙的2倍。在其它条件不变的情况下,若增加反应物的浓度,化学平衡不发生移动,则达到化学平衡时C(C)的浓度也应该是乙的2倍。现在2C(C)(乙)=C(C)(丙).说明改变反应物的浓度,化学平衡没有发生改变。只有在反应前后气体体积相等的可逆反应中,改变压强或改变浓度,化学平衡不移动。所以1+X=2,X=1.错误。C. 若平衡后保持温度不变,由于该反应是反应前后气体体积相等的可逆反应。改变容器体积,即改变压强,根据平衡移动原理,化学平衡不移动。正确。D.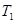 ℃下,起始时向甲容器中充入1.5molA、0.5molB,达到化学平衡时A的转化率为:(0.75÷1.5)×100%=50%.在该温度下,若起始时向甲容器中充入0.5molA、0.5molB,平衡时A的转化率为25%,然后再加入1molB,,增大反应物的浓度,平衡向正反应方向移动,故A的转化率就大于25%。错误。
℃下,起始时向甲容器中充入1.5molA、0.5molB,达到化学平衡时A的转化率为:(0.75÷1.5)×100%=50%.在该温度下,若起始时向甲容器中充入0.5molA、0.5molB,平衡时A的转化率为25%,然后再加入1molB,,增大反应物的浓度,平衡向正反应方向移动,故A的转化率就大于25%。错误。
本题难度:一般
5、选择题 向体积一定的密闭容器中通入2体积SO2和1体积O2在一定条件下发生反应 并达到平 衡。此时容器内硫原子数与氧原子数之比为1:3,则SO2的平衡转化率为
并达到平 衡。此时容器内硫原子数与氧原子数之比为1:3,则SO2的平衡转化率为
[? ]
A.10%
B.50%
C.90%
D.以上都有可能
参考答案:D
本题解析:
本题难度:一般