1、填空题 运用化学反应原理研究常见元素的单质及其化合物有重要意义。
(1)合成氨反应N2 (g)+3H2(g)  ?2NH3(g),△H<0。若在恒温、恒压条件下向平衡体系中通入氩气,则平衡?移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不变”)。
?2NH3(g),△H<0。若在恒温、恒压条件下向平衡体系中通入氩气,则平衡?移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不变”)。
(2)向Na2C2O4溶液加入少量石蕊,溶液显?色,请用离子方程式表示出现该现象的原因:?;
(3)pH相同的氨水和氢氧化钠,分别用蒸馏水稀释至原来溶液的100倍,则稀释后两种溶液的pH分别为m和n,则m??n(选填“>”“<”“=”);
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl―NH4Cl为电解质溶液制造新型燃料电池。请写出该电池的正极反应式?。
(5)氢气燃烧热值高。实验测得,在常温常压下,4gH2完全燃烧生成液态水,放出571.6kJ热量,则表示H2燃烧热的热化学方程式为?。
(6)某温度(t℃)时,测得0.01mol?L-1的NaOH溶液的pH=11。在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则Va∶Vb=?。
参考答案:
(15分)(1)向左;不变
(2)蓝,C2O42-+H2O  ?HC2O4-+OH-
?HC2O4-+OH-
(3)>
(4)N2+8H++6e-=2NH4+
(5)H2(g)+1/2 O2(g)=H2O(l)?;△H=-285.8kJ?mol-1
(6)1:10
本题解析:略
本题难度:简单
2、选择题 按粒子的半径从小到大顺序排列的是( )?
A.Cl、S、P
B.N、O、F
C.Al3+、Mg2+、Na+?
D.K、Na、Li?
参考答案:AC
本题解析:比较原子半径大小可以套用相关规律:①电子层数相同的原子的原子半径,随核电荷数的增加逐渐减小(稀有气体除外)。则A. Cl<S<P B. N>O>F。②最外层电子数相同的原子的原子半径,随电子层数(或核电荷数)的增大而增大。则D. K>Na>Li;比较离子半径大小可以根据核外电子排布相同的离子半径,随核电荷数的增大而减小。则C. Al3+<Mg2+<Na+。
本题难度:简单
3、选择题 向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如下图所示。则下列分析与判断不正确的是(不计CO2的溶解)?(?)
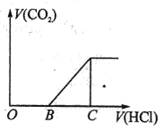
A.若OB=0,则形成溶液M所发生的离子反应方程式为:OH-+CO2=HCO3-
B.若OB=BC,则溶液M为Na2CO3溶液
C.若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3-
D.若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
参考答案:C
本题解析:向Na2CO3溶液中逐滴加入盐酸,反应原理为:
Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+CO2+H2O,即从Na2CO3到NaHCO3所消耗盐酸的量相等。对A,若OA=0,表明开始滴加盐酸就有气体生成,则M中的溶质NaHCO3,反应为CO2+OH—=HCO3—;对B,若OB=BC,说明生成HCO3—消耗的H+与HCO3—产生CO2消耗的H+相等,则M中的溶质为Na2CO3;对C,OB>BC,说明不产生CO2消耗H+大于产生CO2消耗的H+量,M中溶质应为NaOH和Na2CO3,若OB<BC,说明不产生CO2消耗H+小于产生CO2消耗的H+量,M中溶质应为Na2CO3和NaHCO3;对D,3OB=BC,M中溶质为Na2CO3和NaHCO3,因为Na2CO3~NaHCO3,故c(NaHCO3=2c(Na2CO3)。
本题难度:简单
4、选择题 湿润的蓝色石蕊试纸接触氯气后,其颜色变化为( )
A.变红
B.先变红后变白
C.变白
D.不变
参考答案:湿润的蓝色石蕊试纸接触氯气,相当于是在蓝色石蕊试纸上滴加新制的氯水,新制的氯水中存在的微粒有:
分子:Cl2、HClO、H2O;离子:H+、Cl-、ClO-、OH-.H+使湿润的蓝色石蕊试纸变红(很快),HClO氧化有色物质为无色物质(较慢),所以现象为:先变红后变白.故A、C、D错,B对
故选B
本题解析:
本题难度:简单
5、选择题 化学中常用类比的方法可预测许多物质的性质。如根据H2+Cl2=2HCl推测:H2+Br2=2HBr。但类比是相对的,如根据2Na2O2+2CO2= Na2CO3+ O2,?类2Na2O2+2SO2= Na2SO3+ O2是错误的,应该是Na2O2+SO2= Na2SO4。
下列各组类比中正确的是?(?)
A.由NH4Cl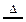 NH3↑+HCl↑,推测:NH4I
NH3↑+HCl↑,推测:NH4I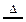 NH3↑+HI↑
NH3↑+HI↑
B.由CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,推测:2SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO
C.由2CO2+Ca(ClO)2+2H2O=Ca(HCO3)2+2HClO,推测:CO2+NaClO+H2O=NaHCO3+HClO
D.由Na2SO3+2HCl=2NaCl+H2O+ SO2↑,推测:Na2SO3+2HNO3=2NaNO3+H2O+ SO2↑
参考答案:C
本题解析:本题考查元素化合物知识的一般规律及特殊性,NH4I受热分解为 NH3、I2、H2, SO2和Ca(ClO)2应发生氧化还原Na2SO3和HNO3也要发生氧化还原。故选C
本题难度:一般