1、填空题 “84”消毒液是生活中常用的含氯消毒剂,其制备过程的主要反应是将氯气通入氢氧化钠溶液中,反应的化学方程式为_________________,“84”消毒液中的有效成分是__________(填名称)。
参考答案:Cl2+2NaOH==NaCl+NaClO+H2O;次氯酸钠
本题解析:
本题难度:一般
2、选择题 下列卤族元素的有关实验,说法正确的是
A.往稀米粥中加入少量加碘食盐,能检验食盐中是否含碘
B.已知I3-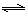 I2+I-,向盛有KI3溶液的试管中加人适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加人适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大
C.用溴水即可鉴别苯酚溶液、2,4-己二烯和苯
D.浓盐酸长期暴露在空气中因为见光分解而浓度降低
参考答案:C
本题解析:A:食盐中的碘元素以KIO3的形式存在,与米粥中的淀粉无任何反应及现象;B:CCl4层显紫红色是由于碘单质在其中的溶解度大于在水中的溶解度所致。C:溴水可使苯酚显紫色、与2,4-己二烯褪色、与苯不能褪色但分层,故用溴水即可鉴别三者;D:盐酸为挥发性酸,暴露在空气中因挥发而浓度降低。故选C
本题难度:一般
3、选择题 用氯气消毒过的自来水配制下列溶液时,会使配得的溶液变质的是
①NaOH?②AgNO3?③Na2CO3?④FeCl2
A.②④
B.①②③
C.①③
D.①②③④
参考答案:D
本题解析:氯水中含有氯气和次氯酸,均具有氧化性。同时氯水中还含有氯化氢,显酸性。所以中试剂均会变质,答案是D。
本题难度:一般
4、填空题 (11分)氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O  ?HCl + HClO?K=4.5×10-4
?HCl + HClO?K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为?。
(2)使用氯气为自来水消毒可以有效 地控制次氯酸的浓度,请结合平衡常数解释原因:?。
地控制次氯酸的浓度,请结合平衡常数解释原因:?。
(3)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为?。
(4)二氧化氯是目前国际上公认的最新一代的高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为?。
(5)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。
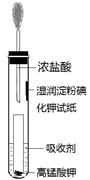
①下列溶液能吸收Cl2的是?(填字母序号)。
A.饱和食盐水
B.饱和Na2SO3溶液
C.饱和NaOH溶液
D.浓硫酸