1、选择题 向20mL 10mol/L的浓盐酸中加入足量的二氧化锰固体上并加热,若不考虑HCl的挥发,则被氧化的HCl的物质的量为……( ?)
A.小于0.1mol
B.等于0.1mol
C.大于0.1mol,小于0.2mol
D.等于0.2mol
参考答案:A
本题解析:因随着反应进行,浓盐酸变为稀盐酸,而不再能制备Cl2。
说明:高中阶段这一问题不应该有争议。
本题难度:一般
2、填空题 浩瀚的海洋是一个巨大的宝库,蕴含有80多种元素,可供提取利用的有50多种。
(1)其中“氯碱工业”就是以食盐水为原料制取Cl2等物质,有关的化学方程式为:?。
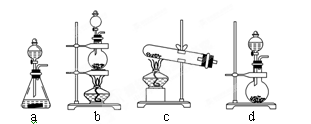
(2)实验室用二氧化锰制取氯气的化学方程式为:?;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气?(填写装置的序号)。
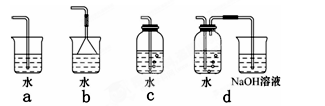
(3)实验室中模拟Br—→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现。写出Br—→Br2的转化离子方程式为:?;氯水不稳定,要现用现配,下列吸收氯气制备氯水的装置最合理的是?(选填下列选项的编号字母)。
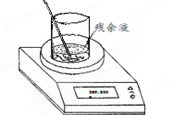
(4)实验室制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学进行了以下实验:取100 mL残余液放入烧杯中,将烧杯(含玻璃棒)放在电子天平上(如右图),再把已称好50.0 g CaCO3粉末慢慢加入到残余液中,边加边搅拌使其充分反应。观察读数变化如下表所示:
CaCO3用量
| 未加CaCO3时
| 加约四分之一时
| 加一半时
| 全部加完时
|
读数/g
| 318.3
| 325.3
| 334.5
| 359.5
|
请你据此分析计算:
①实验中产生的CO2气体质量为?;
②残余液中盐酸的物质的量浓度为 (结果精确到小数点后一位)?。
参考答案:(1)2NaCl+2H2O 2NaOH+H2↑+Cl2↑(2分)
2NaOH+H2↑+Cl2↑(2分)
(2)MnO2+4HCl(浓)  MnCl2+2H2O+Cl2↑(2分);b(1分)
MnCl2+2H2O+Cl2↑(2分);b(1分)
(3)2Br-+Cl2=2Cl-+Br2(2分);d(1分) (4)①8.8g(2分);②4.0mol/L(3分)
本题解析:(1)“氯碱工业”是以食盐水为原料,通过电解法制取Cl2等物质,有关的化学方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
(2)实验室用二氧化锰制取氯气的化学方程式为MnO2+4HCl(浓)  MnCl2+2H2O+Cl2↑。根据方程式可知该反应是固体与液体加热制备气体,因此需要的主要仪器是酒精灯、分液漏斗、烧瓶,则实验装置应该是装置b,即答案选b。
MnCl2+2H2O+Cl2↑。根据方程式可知该反应是固体与液体加热制备气体,因此需要的主要仪器是酒精灯、分液漏斗、烧瓶,则实验装置应该是装置b,即答案选b。
(3)氯气的氧化性强于单质溴的,能把溴离子氧化生成单质溴,所以Br—→Br2的转化离子方程式为2Br-+Cl2=2Cl-+Br2。氯气能溶于水,但溶解度很小。另外氯气有毒,需要尾气处理,可以用氢氧化钠溶液吸收,因此正确的答案选d。
(4)①根据质量守恒定律可知,反应中产生CO2的质量=318.3g+50.0g-359.5g=8.8g。
②CO2的物质的量=8.8g÷44g/mol=0.2mol,则根据方程式可知
CaCO3+2HCl=CaCl2+H2O+CO2↑
2mol? 1mol
0.4mol? 0.2mol
所以盐酸的浓度=0.4mol÷0.1L=4.0mol/L
本题难度:一般
3、选择题 将氯气分别通入含有下列离子的溶液中,其中的离子不发生变化的是(?)
A.SO42-
B.Fe2+
C.HCO3-
D.OH-
参考答案:A
本题解析:氯气溶于水生成次氯酸和盐酸,所得溶液是氯水,溶液显酸性,还具有氧化性。A正确,亚铁离子被氧化,HCO3-、OH-和氢离子反应,答案选A。
点评:在氯水中既显酸性,还具有强氧化性,所以在判断有关氯水的试题中,主要从这两个方面考虑。
本题难度:一般
4、选择题 下列物质中呈浅黄绿色的是(?)
A.常温时的氯气
B.新制的浓氯水
C.氯化铜溶液
D.氯化氢
参考答案:B
本题解析:结合实验观察,可知:
A选项:常温时氯气的颜色为黄绿色,不是浅黄绿色。
B选项:氯气溶于水制成氯水时,其颜色为浅黄绿色。
C选项:氯化铜溶液的颜色,浓度大时为绿色,浓度小时为蓝色。
D选项:氯化氢气体为无色。
本题难度:简单
5、选择题 下列气体排放到大气中,不会造成污染的是( )
A.Cl2
B.N2
C.NO2
D.NO
参考答案:A.Cl2有毒,不能排放到空气中,否则会造成污染,故A错误;
B.氮气为空气的主要成分,排放到空气中不会造成污染,故B正确;
C.NO2有毒,不能排放到空气中,否则会造成光化学污染和酸雨,故C错误;
D.NO有毒,不能排放到空气中,否则会造成光化学污染和酸雨,故D错误.
故选B.
本题解析:
本题难度:简单