1、选择题 100℃时,NaCl溶液中c(H+)=1×10-6 mol/L。下列说法中正确的是(? )?
A.该NaCl溶液显酸性
B.该NaCl溶液显碱性
C.该NaCl溶液中KW=c(H+)·c(OH-)=1×10-14
D.该NaCl溶液中KW=c(H+)·c(OH-)=1×10-12
参考答案:D
本题解析:NaCl为强酸强碱盐,其水溶液显示出中性,所以AB错误,根据
KW=c(H+)·c(OH-)=1×10-6×1×10-6=1×10-12,可知答案为D。
点评:该题考查了水的离子积,是高考的重要考点之一,比较容易,但是要注意与之前初中的PH值进行区别,中性溶液的PH并不一定是7,要看具体情况而定。
本题难度:简单
2、填空题 复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值

复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3==2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是
___________(填编号)。
A.CO2+H2O +2NaClO = Na2CO3+2HClO
B.CO2+H2O +NaClO = NaHCO3+HClO
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH
NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F.CH3COOH+NaCN = CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是______
(填编号),其pH值为_______(填数值);pH最大的是_______(填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体请根据上述反应,总结出复分解反应发生的另一规律:____________________________。
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是______________,反应的离子方程式为_____________________。
参考答案:(1)AD
(2)⑤;1;①
(3)复分解反应能够向生成更难溶(溶解度更小)物质的方向进行
(4)白色固体变成黄色;I-+AgCl==AgI+Cl-
本题解析:
本题难度:一般
3、选择题 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如下图所示。据图分析,下列判断错误的是
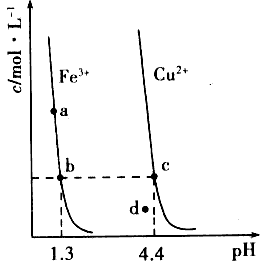
[? ]
A.Ksp[Fe(OH)3] Ksp[Cu(OH)2]
Ksp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列说法正确的是(? )
A.向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.在一定温度下AgCl的水溶液中,Ag+和Cl-物质的量浓度的乘积是一个常数
C.25oC时Ksp(AgCl)=l.8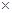 10-10,Ksp(AgI)=1.0×10-16,因此AgCl可以转化为AgI
10-10,Ksp(AgI)=1.0×10-16,因此AgCl可以转化为AgI
D.温度一定时,当溶液中Ag+和Cl-物质的量浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液
参考答案:CD
本题解析:溶度积常数只与温度有关系,A不正确;B不正确,因为该溶液不一定是饱和溶液;根据沉淀容易向溶解度更小的方向进行转化可知,C正确;根据Qc和Ksp的关系可知,D也是正确的,答案选CD。
点评:该题是中等难度的试题,也高考中的常见题型,属于中等难度的试题。该题基础性强,注重考查知识的灵活性,侧重考查学生分析问题、解决问题的能力。
本题难度:一般
5、选择题 化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数
参考答案:B
本题解析:根据沉淀转化向溶度积小的方向进行,Ksp(MnS)>Ksp(CuS),A项正确;该反应达平衡时c(Mn2+)、c(Cu2+)保持不变,但不一定相等,B项错误;往平衡体系中加入少量CuSO4固体后,平衡向正反应方向移动,c(Mn2+)变大,C项正确;该反应的平衡常数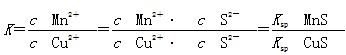 ,D项正确。
,D项正确。
本题难度:一般