1、填空题 根据下图所示实验回答下列问题:

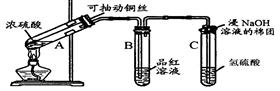
 (1)试管C口部的棉团上发生反应的离子方程式是?。
(1)试管C口部的棉团上发生反应的离子方程式是?。
 (2)试管B中的实验现象是?,若将该试管中反应后的溶液加热,可以观察到?。试管C中溶液变浑浊,则证明SO2具有?性。
(2)试管B中的实验现象是?,若将该试管中反应后的溶液加热,可以观察到?。试管C中溶液变浑浊,则证明SO2具有?性。
 (3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是?,如果浸NaHCO3溶液,则发生反应的化学方程式是?。
(3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是?,如果浸NaHCO3溶液,则发生反应的化学方程式是?。
参考答案:(1)SO2 +2OH-=SO32-+H2O (2)红色褪去?溶液又恢复红色?氧化
 (3)吸收有害气体,防止污染空气
(3)吸收有害气体,防止污染空气
 NaHCO3+SO2=NaHSO3+CO2(或2NaHCO3+SO2=Na2SO3+2CO2↑+H2O)
NaHCO3+SO2=NaHSO3+CO2(或2NaHCO3+SO2=Na2SO3+2CO2↑+H2O)
本题解析: Cu丝与浓H2SO4在加热条件下生成SO2气体,通入品红溶液,SO2有漂白性,使品红溶液褪色,加热恢复红色;过量的SO2气体,通入H2S溶液中,发生反应:2H2S+SO2
Cu丝与浓H2SO4在加热条件下生成SO2气体,通入品红溶液,SO2有漂白性,使品红溶液褪色,加热恢复红色;过量的SO2气体,通入H2S溶液中,发生反应:2H2S+SO2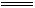 2H2O+3S↓,SO2是氧化剂,为防止过量的SO2逸出污染空气,用NaOH溶液吸收,如用NaHCO3溶液代替NaOH也可以,因NaHCO3溶液能与SO2反应。
2H2O+3S↓,SO2是氧化剂,为防止过量的SO2逸出污染空气,用NaOH溶液吸收,如用NaHCO3溶液代替NaOH也可以,因NaHCO3溶液能与SO2反应。
本题难度:一般
2、选择题 下列关于浓HNO3和浓H2SO4的叙述,正确的是
A.都不易分解
B.常温下都能与铜较快反应
C.露置在空气中,容器内溶液的质量都减小
D.露置在空气中,容器内溶液的浓度都减小
参考答案:D
本题解析:A、不正确,浓硝酸不稳定,易分解;4HNO3 2H2O+4NO2+O2;B、浓H2SO4在常温下与铜反应较慢;C、露置在空气中,容器内浓硝酸的质量减小,但浓硫酸具有吸水性,质量变大;D、正确,浓硝酸挥发,浓硫酸吸水,容器内溶液的浓度都减小。选D。
2H2O+4NO2+O2;B、浓H2SO4在常温下与铜反应较慢;C、露置在空气中,容器内浓硝酸的质量减小,但浓硫酸具有吸水性,质量变大;D、正确,浓硝酸挥发,浓硫酸吸水,容器内溶液的浓度都减小。选D。
本题难度:一般
3、选择题 标准状况下H2S和O2混合气体100mL,经点燃后反应至完全,所得气体经干燥后,恢复到原来状况时体积为10mL,该10mL气体可能是?(?)

A.H2S、SO2
B.O2
C.H2S
D.SO3
参考答案:C
本题解析: H2S和O2反应后的气体产物可能为①H2S;②SO2;③SO2和O2。
H2S和O2反应后的气体产物可能为①H2S;②SO2;③SO2和O2。
 如为情况①,说明H2S过量。
如为情况①,说明H2S过量。
 则由:2H2S+O2=2H2O+2S体积减少
则由:2H2S+O2=2H2O+2S体积减少
 2? 1? 3
2? 1? 3
 ?60?30? 100-10="90?"
?60?30? 100-10="90?"
 参加反应的H2S和O2的总体积为60+30=90,则余下的10mL气体为H2S。
参加反应的H2S和O2的总体积为60+30=90,则余下的10mL气体为H2S。
 若为情况②或③,说明O2过量。
若为情况②或③,说明O2过量。

 则由:2H2S+3O2=2H2O+2SO2体积减少
则由:2H2S+3O2=2H2O+2SO2体积减少
 ? 2? 3? 2? 3
? 2? 3? 2? 3
 ??60 ??90??90
??60 ??90??90
 则参加反应的H2S和O2的总体积为60+90=150>100,所以这两种情况不存在。
则参加反应的H2S和O2的总体积为60+90=150>100,所以这两种情况不存在。
本题难度:一般
4、选择题 下列不能说明氯的非金属性比硫强的事实是?
[?]
①HCl比H2S稳定?②HClO氧化性比H2SO4强?③HClO4酸性比H2SO4强? ④Cl2能与H2S反应生成S?⑤Cl原子最外层有7个电子,S原子最外层有6个电子 ?⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS?⑦HCl酸性比H2S强
A.②⑤⑦?
B.①②⑦?
C.②④?
D.①③⑤
参考答案:A
本题解析:
本题难度:简单
5、选择题 有下列两种转化途径,某些反应条件和产物已省略,下列有关说法不正确的是
途径① S H2SO4
H2SO4
途径② S SO2
SO2 SO3
SO3 H2SO4
H2SO4
A.途径①反应中体现了浓HNO3的强氧化性和酸性
B.途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本
C.由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e-
D.途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高
参考答案:A
本题解析:途径①反应中只体现了浓HNO3的强氧化性,没有酸性,所以A错误,其余选项均正确。答案选A。
点评:本题非常简单基础。
本题难度:一般