1、计算题 反应2A(g)+B(g) 3C(g),起始时按5∶2的体积比把A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使之反应,达平衡时混合气体中C的体积分数为60%,求:
3C(g),起始时按5∶2的体积比把A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使之反应,达平衡时混合气体中C的体积分数为60%,求:
(1)A、B的转化率。
(2)平衡时混合气体的平均相对分子质量〔设A的相对分子质量为Mr(A),B的相对分子质量为Mr(B)〕。
(3)平衡时压强与起始时相比,有何变化?
参考答案:(1)α(A)=56%,α(B)=70%
(2) 
(3)反应前后压强不变
本题解析:设起始时A为5 mol,则B为2 mol,达平衡时反应的A的物质的量为x。
2A? +? B 3C
3C
起始:5 mol? 2 mol? 0
转化:x?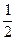 x?
x?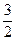 x
x
平衡:(5 mol-x) 2 mol- ?
?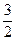 x
x
则 =0.6,
=0.6,
x="2.8" mol。
所以,平衡时,A的转化率为56%,B的转化率为70%。
(2)反应前后气体的物质的量不变,所以 。
。
本题难度:简单
2、实验题 某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72—转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
实验编号
| 初始pH
| 废水样品体积/mL
| 草酸溶液体积/mL
| 蒸馏水体积/mL
|
①
| 4
| 60
| 10
| 30
|
②
| 5
| 60
| 10
| 30
|
③
| 5
| 60
| ?
| ?
|
?
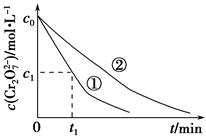
测得实验①和②溶液中的Cr2O72—浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为________(填化学式)。
(3)实验①和②的结果表明________;实验①中0~t1时间段反应速率v(Cr3+)=________mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:________;
假设三:________;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O72—的浓度可用仪器测定)
实验方案(不要求写具体操作过程)
| 预期实验结果和结论
|
?
参考答案:(1)
实验编号
初始pH
废水样品体积/mL
草酸溶液体积/mL
蒸馏水体积/mL
3
?
?
20
20
?
(2)CO2
(3)溶液pH对该反应的速率有影响 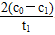
(4)Al3+起催化作用 SO42—起催化作用
(5)
实验方案(不要求写具体操作过程)
预期实验结果和结论
用等物质的量的K2SO4·Al2(SO4)3·24H2O代替实验①中的铁明矾,控制其他条件与实验①相同,进行对比实验
反应进行相同时间后,若溶液中c(Cr2O72—)大于实验①中的c(Cr2O72—)则假设一成立,若两溶液中的c(Cr2O72—)相同,则假设一不成立
本题解析:(1)根据题意要求,调节不同初始pH和一定浓度草酸溶液用量,做对比实验,由此可知实验③改变的是草酸溶液用量,但应保持溶液总体积不变。(2)草酸中碳的化合价为+3价,与强氧化性物质K2Cr2O7反应后,草酸应被氧化为CO2。(3)根据实验①、②的曲线对比,在相同草酸用量不同pH时,反应速率不同,所以pH对该反应有一定的影响;在0~t1时间段内,v(Cr2O72—)=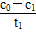 mol·L-1·min-1,由Δc(Cr3+)=2Δc(Cr2O72—)所以v(Cr3+)=
mol·L-1·min-1,由Δc(Cr3+)=2Δc(Cr2O72—)所以v(Cr3+)=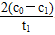 mol·L-1·min-1。(4)根据铁明矾组成离子可知,起催化作用的离子可能为Fe2+、Al3+、SO42—。(5)可通过在其他条件不变时,加入等物质的量的K2SO4·Al2(SO4)3·24H2O替代实验中的铁明矾,此时溶液中不存在Fe2+,但仍存在SO42—和Al3+,通过测定c(Cr2O72—)看是否仍然有催化效果来判断。
mol·L-1·min-1。(4)根据铁明矾组成离子可知,起催化作用的离子可能为Fe2+、Al3+、SO42—。(5)可通过在其他条件不变时,加入等物质的量的K2SO4·Al2(SO4)3·24H2O替代实验中的铁明矾,此时溶液中不存在Fe2+,但仍存在SO42—和Al3+,通过测定c(Cr2O72—)看是否仍然有催化效果来判断。
(本题属于开放性试题合理答案均可)
本题难度:一般
3、选择题 下列反应中生成H2的速率最快的是
[? ]
金属?
酸溶液
温度
A.
Mg
0.5mol/L H2SO4
20℃
B.
Fe
1 mol/L HCl
20℃
C.
Mg?
2 mol/L HCl
20℃
D.
Mg
1 mol/L H2SO4
30℃
参考答案:D
本题解析:
本题难度:一般
4、选择题 对处于平衡状态的反应2A(g)+B(g) 2C(g)?△H<0,下列叙述正确的是
2C(g)?△H<0,下列叙述正确的是
A.增大A浓度的瞬间,V?正 增大,V?逆不变
B.升高温度,V?正 减小,V?逆增大
C.增大压强. V?正 增大,V?逆 减小
D.加入催化剂,V?正、V?逆 都增大
参考答案:A
本题解析:增大反应物A的浓度,瞬间增大正反应的速率,但生成物的浓度瞬间不变,所以你反应速率不变,A正确;△H<0说明该反应的正反应是放热反应,所以升高温度影响的只是使平衡逆向移动,但是正逆反应都会瞬间同时增大,故B错误;反应中反应物和生成物均是气体,所以增大压强是反应物和生成物的浓度都瞬间增大,所以正逆反应速率都增大,C错误;加入催化剂不改变平衡,只是使正逆反应速率同等程度增大;故选A。
本题难度:一般
5、选择题 可逆反应mA(g)+nB(s) rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分含量和温度T或压强P关系如图所示,下列叙述中正确的是
rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分含量和温度T或压强P关系如图所示,下列叙述中正确的是
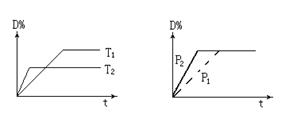
A.化学方程式系数m+n=r+q
B.使用催化剂,D的物质的量分数增加
C.温度降低,化学平衡向正反应方向移动
D.物质B的颗粒越小,反应越快,有利于平衡向正反应方向移动
参考答案:C
本题解析:A.由右图可知,压强为P2先到达平衡,故P2>P1,增大压强,D%不变,则平衡不移动,反应中B为固体,故m=r+q,故A错误;B.使用催化剂,缩短到达平衡时间,平衡不移动,D%的不变,故B错误;C、由左图知,温度T2为先到达平衡,故T2>T1,升高温度,D%减小,则平衡向逆反应移动,因此温度降低,化学平衡向正反应方向移动,C正确;D.B为固体,物质B的颗粒越小,接触面积越大,反应越快,但对平衡移动没有影响,故D错误,故选C。
考点:考查化学平衡的移动、化学平衡影响因素、化学平衡图象等
本题难度:一般