1、填空题 (1)已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
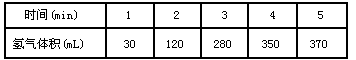
①反应速率最大的(即0 min~1 min、1 min~2min、2 min~3min、 3 min~4 min、4 min~5 min)时间段为_____________,原因是______________。
②反应速率最小的时间段为______________,原因是_________________。
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列哪些溶液以减慢反应速率。
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他的做法可行的是____________(填相应编号);做法不可行的理由是__________________。
参考答案:(1)①2min~3 min? ;因该反应是放热反应,此时温度高
②4 min~5min ;此时H+浓度小
(2)AC? ;置换出Cu,形成Cu-Zn原电池反应,使反应加快
本题解析:
本题难度:一般
2、填空题 “碘钟” 实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃时进行实验,得到的数据如下表

?回答下列问题: ?
(1)该实验的目的是________。 ?
(2)显色时间t1=____。 ?
(3)温度对该反应的反应速率的影响符合一般规律,若在 40℃下进行编号③对应浓度的实验,显色时间t2的范围为____(填字母)。 ?
A.?<22.0?s?B.22.0s-44.0?s ?C.>44.0s?D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是_________________。
参考答案:(1)研究反应物I-与S2O82-的浓度对化学反应速率的影响?
(2)29.3s?
(3)A?
(4)反应速率与反应物起始浓度的乘积成正比(或显色时间与反应物起始浓度乘积成反比)
本题解析:
本题难度:一般
3、计算题 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下的方案。
编号
| H2C2O4溶液
| 酸性KMnO4溶液
| 温度/℃
|
浓度/ mol?L-1
| 体积/mL
| 浓度/ mol?L-1
| 体积/mL
|
①
| 0.10
| 2.0
| 0.010
| 4.0
| 25
|
②
| 0.20
| 2.0
| 0.010
| 4.0
| 25
|
③
| 0.20
| 2.0
| 0.010
| 4.0
| 50
|
?
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1mol H2C2O4转移_____mol 电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:c(H2C2O4)∶c(KMnO4) ≥______________。
(2)探究温度对化学反应速率影响的实验编号是___________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是_____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______________ mol?L-1?min-1。
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图。

参考答案:(16分)(1)2? 2.5(每空3分)
(2)②和③?①和②(每空2分)
(3)0.010或1.0 ×10-2(3分,0.01得2分)
(4)如图(3分。标注1分,正确做图2分)

本题解析:(1)草酸中碳元素为+3价,二氧化碳中碳元素为+4价,由化合价升高总数等于转移电子数可知1个H2C2O4转移2个电子,则每消耗1molH2C2O4转移2mol 电子;草酸与酸性高锰酸钾溶液反应为5H2C2O4+2KMnO4+3H2SO4=10CO2↑+K2SO4+2MnSO4+8H2O~10e-,只有当KMnO4完全反应,溶液的紫红色才能褪去,如果n(H2C2O4)=5mol、n(KMnO4)≤2mol,就能观察到紫色褪去,所以c(H2C2O4)∶c(KMnO4) = n(H2C2O4)∶n(KMnO4)≥2.5;(2)根据控制变量设计探究实验方案原则,实验②和③所用试剂的浓度、体积均相同,反应温度分别为25℃、50℃,这组对比实验的目的是探究温度对化学反应速率的影响;实验①和②的温度相同,酸性高锰酸钾溶液的浓度、体积均相同,草酸浓度分别为0.1mol/L、0.2mol/L,这组实验的目的是探究浓度对化学反应速率的影响;实验①和③既改变了反应物的浓度,又改变了反应温度,不能得到合理的结论;(3)实验①中:2.0mL草酸溶液加入4.0mL酸性高锰酸钾溶液,能稀释后者,设稀释后高锰酸钾的初始浓度为xmol/L,根据题意和稀释定律(c1?V1=c2?V2)可知,0.010 mol?L-1×4.0×10-3L=x mol?L-1×(4.0+2.0)×10-3L,则x=0.010 mol?L-1×4.0/6.0,紫色恰好褪色时高锰酸钾浓度减小为0,则△c(KMnO4) =0.010 mol?L-1×4.0/6.0,而△t=40/60min,由v=△c/△t可得,v(KMnO4)=△c(KMnO4)/△t=0.010 mol?L-1×4.0/6.0÷40/60min=0.010 mol?L-1?min-1;(4)根据控制变量原则,高锰酸根离子的起始浓度不变,仅仅降低温度,反应速率减小,则褪色的时间增大,相同时间内高锰酸根离子的变化浓度减小,则25℃时反应过程中c(MnO4-)~t的变化曲线位于50℃时曲线的右边。
本题难度:困难
4、实验题 已知KMnO4和H2C2O4在酸性溶液中发生反应:____KMnO4+____H2C2O4+_____H2SO4→____K2SO4+
____MnSO4+_____CO2↑+_____H2O。
(1)配平上述方程式。
甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下:
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小,实验装置如图所示。
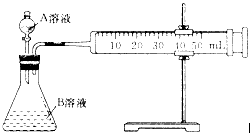
实验时A溶液一次性放下,A,B的成分见下表
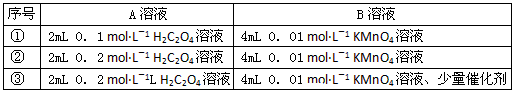
该实验探究的是__________对化学反应速率的影响。在反应停止之前,相同时间内针筒中所得CO2的体积由大到小的顺序是_____________(用实验序号填空)。
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。取两支试管各加入
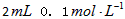 ?H2C2O4溶液,另取两支试管各加入
?H2C2O4溶液,另取两支试管各加入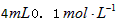 KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究__________对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是_____________________________________。
KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究__________对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是_____________________________________。
参考答案:(1)2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+10CO2↑+8H2O
(2)浓度和催化剂;③②①
(3)温度;KMnO4溶液过量
本题解析:
本题难度:困难
5、填空题 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
实验编号
| H2C2O4溶液
| 酸性KMnO4溶液
| 温度
|
浓度(mol·L-1)
| 体积(mL)
| 浓度(mol·L-1)
| 体积 (mL)
|
①
| 0.10
| 2.0
| 0.010
| 4.0
| 25
|
②
| 0.20
| 2.0
| 0.010
| 4.0
| 25
|
③
| 0.20
| 2.0
| 0.010
| 4.0
| 50
|
?
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1molH2C2O4转移_______mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4)∶n(KMnO4)≥______。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=________mol·L-1·min-1。
(4)已知实验③中c(MnO4-)~反应时间t的变化曲线如下图。若保持其他条件不变,请在图中画出实验②中c(MnO4-)~t的变化曲线示意图。

参考答案:(1)2 2.5(或5:2) ?(2)②和③, ①和② ?(3)0.010
(4)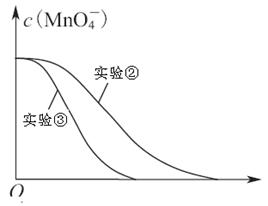
本题解析:(1)高锰酸钾溶液与草酸反应的化学方程式为:2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + MnSO4 + 10CO2↑+ 8H2O,反应中C的化合价由+3价升高到+4价,所以每消耗1molH2C2O4转移2mol电子;为了观察到紫色褪去,则KMnO4必须完全反应,从方程式可看出:n(H2C2O4) n(KMnO4)≥5∶2。(2)分析表中数据可看出,②和③两个实验仅温度不同,①和②两个实验仅草酸浓度不同,所以探究温度对化学反应速率影响的实验是②和③,探究反应物浓度对化学反应速率影响的实验是①和②。(3)用KMnO4溶液表示的平均反应速率为: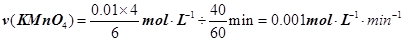 。(4)实验比较实验的反应温度低,则反应速率小,KMnO4溶液褪色时间长,c(MnO4-)~t的变化曲线示意图见答案。
。(4)实验比较实验的反应温度低,则反应速率小,KMnO4溶液褪色时间长,c(MnO4-)~t的变化曲线示意图见答案。
本题难度:一般