| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《物质的量》高频试题巩固(2019年最新版)(十)
参考答案:BD 本题解析:根据说明,知道每片溶解了500mg的碳酸钙,而不是Ca2+,A错;500mg的CaCO3的物质的量为0.005mol,反应生成的CO2的物质的量也为0.005mol,标准状况下的体积为112mL,B对;CaCO3是难溶物,写离子方程式时要写成化学式,C错;能生成气体说明说明了柠檬酸的酸性比碳酸强,D对。 本题难度:一般 3、选择题 若NA代表阿伏加德罗常数,下列说法正确的是 ( ) |
参考答案:D
本题解析:A错,如氯气与氢氧化钠反应,1 molCl2参加反应转移电子数一定为NA;B错,1L为溶剂的体积不是溶液的体积;C错,应在标准状况下才正确;D正确;
本题难度:一般
4、选择题 天然所的主要成分为CH4。 1 mol CH4的质量为
A.16g
B.16
C.32g
D.16g/mol
参考答案:A
本题解析:根据n=m/M,可得1 mol CH4的质量为1×16g/moL=16g,选A。
考点:考查质量的计算。
本题难度:一般
5、计算题 (8分)(1)实验室常用的浓盐酸密度为1.17g/mL、质量分数为36.5%。此浓盐酸的物质的量浓度为?mol/L。取此浓盐酸43mL,用蒸馏水稀释至200mL,稀盐酸的物质的量浓度为?mol/L。
(2)?4.8g镁投入此200mL稀盐酸中,反应后,求:
①放出的H2在标准状况下的体积。
②将生成的H2通过过量的灼热CuO,求被还原出的铜的质量。
③反应后(设溶液体积不变)溶液中两种阳离子的物质的量浓度之比。
参考答案:①放出的H2在标准状况下的体积为4.48L。②被还原出铜的质量为12.8g
③反应后溶液中Mg2+和H+物质的量浓度之比为2∶1
本题解析:(1)11.7,2.52(或2.5或2.515)
(2)①解:? Mg?+ 2HCl = MgCl2?+? H2↑
24g? 2mol? 1mol? 22.4L
4.8g? n(HCl)? n(MgCl2)? V(H2)
∵n(HCl)=0.4mol<0.2L×2.52mol/L
∴盐酸过量,以Mg的量计算
V(H2)=4.48L? n (MgCl2)=" 0.2mol?" ②解:CuO?+? H2? ?Cu + H2O
?Cu + H2O
22.4L? 64g
4.48L? m(Cu)
m(Cu)=12.8g
③解: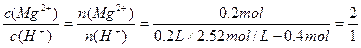
(若分别算出两种离子的物质的量或物质的量浓度得1分)
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《与量有关的.. | |