1、填空题 常温下,将10.0 g 40%的NaCl溶液跟40.0 g 15%的NaCl溶液混合,得到密度为1.17 g·cm-3的混合液,该混合液NaCl的质量分数为 ,物质的量浓度为 。
参考答案:20% 4 mol·L-1(不带单位不给分)
本题解析:略
本题难度:一般
2、填空题 (10分)(1)同温同压下,两种气体A和B的体积之比为2:1,质量之比为8:5,则A与B的密度之比为?,摩尔质量之比为?。
(2)在标准状况下a. 6.72L CH4气体? b.3.01×1023个HCl气体分子? c.13.6g? H2S气体? d.0.2molNH3,下列对这四种气体的关系从大到小的排列是(用上述序号表示)
①四种气体的物质的量?,
②标准状况下四种气体的体积?,
③四种气体的质量?。
参考答案:(10分)(1) 4:5 ; 4:5 (2)①? b>c>a>d?②? b>c>a>d?③? b>c>a>d (每空2分)
本题解析:考查物质的量的有关计算。
(1)根据阿伏加德罗定律可知,气体的体积之比是气体的物质的量之比,所以 ,解得
,解得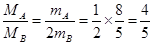 。又因为在相同条件下,气体的密度之比是气体的摩尔质量之比,所以二者的密度之比也是4︰5。
。又因为在相同条件下,气体的密度之比是气体的摩尔质量之比,所以二者的密度之比也是4︰5。
(2)标准状况下 6.72L CH4气体的物质的量是0.3mol,质量是4.8g;3.01×1023个HCl气体分子的物质的量是0.5mol,质量是18.25g;13.6g H2S气体的物质的量是13.6g÷34g/mol=0.4mol;0.2mol氨气的质量是3.4g,所以
①四种气体的物质的量从大到小的排列是b>c>a>d。
②标准状况下四种气体的体积从大到小的排列是b>c>a>d。
③四种气体的质量从大到小的排列是 b>c>a>d。
本题难度:一般
3、选择题 设NA为阿伏加德罗常数值,下列说法中正确的是(? )
A.常温常压下,16 g氧气和臭氧(O3)的混合气体中含有NA 个氧原子

B.将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个
C.12g NaHSO4在熔融时离子总数为0.3NA个
D.标准状况下,11.2L氦气所含的原子数为NA个
参考答案:A
本题解析:略
本题难度:一般
4、选择 题 某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是
[? ]
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法
参考答案:B
本题解析:
本题难度:一般
5、填空题 l mol CO2的质量是一个CO2分子质量的 倍,l mol CO2的质量与CO2的相对分子质量相比,两者 相同,但前者以 为单位。5molCO32-是 g,它和 mol Mg2+含有相同的质量,它和 gSO42-含有相同的离子数。(12分)
参考答案:6.02×1023,数值,克,300g,,12.5mol,480g
本题解析:略
本题难度:一般