1、选择题 下列物质中,含有共价键的离子化合物是
[? ]
A.Na2O2
B.MgCl2
C.NH3
D.KCl
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列说法中正确的是(?)
A.NO2、SO2、BF3分子中所有原子的最外层电子都满足了8e-稳定结构
B.P4和CH4都是正四面体分子且键角都为109o28ˊ
C.CsCl晶体中与每个Cs+距离相等且最近的Cl-共有8个
D.原子晶体的熔沸点一定比金属晶体的高
参考答案:C
本题解析:共价化合物中元素化合价的绝对值和最外层电子数之和满足8,则该元素原子的最外层电子就能满足8电子稳定结构,所以A中N、S、B都不满足,A不正确。白磷的键角是60°的,B不正确。原子晶体的熔沸点不一定比金属晶体的高,例如钨的熔沸点就很高,D不正确。所以答案选C。
本题难度:一般
3、选择题 X、Y、Z、W、R均是短周期元素,它们在元素周期表中的相对位置如图所示,其中W的最高正化合价与最低负化合价绝对值相等.下列说法正确的是( )
A.X、Y形成的某种化合物可作为呼吸面具中X2的来源
B.Z、W、R分别与X形成的化合物的水化物都是强酸
C.气态氢化物的热稳定性:HmX>HmR>WHn
D.化合物YmX和YmR中,阳离子半径均大于阴离子半径
参考答案:W的最高正化合价与最低负化合价绝对值相等,最高正化合价与最低负化合价绝对值之和一定等于8,根据W的位置,可知W硅,Z为Al,Y为Na,R为S,X为O,
A、X、Y形成的化合物有氧化钠和过氧化钠,其中过氧化钠可以和二氧化碳及水反应产生氧气,可作为氧气的来源,故A正确;
B、Z、W、R分别与X形成的化合物的水化物为:Al(OH)3、H2SiO3、H2SO4,它们分别属于碱、弱酸、强酸,故B错误;
C、O、S、Si的得电子能力顺序为:O>S>Si,故气态氢化物的热稳定性:H2O>H2S>SiH4,故C正确;
D、在化合物氧化钠和硫化钠中,钠离子半径小于硫离子半径,故D错误.
故选AC.
本题解析:
本题难度:一般
4、选择题 下列化学用语正确的是
[? ]
A. 乙烯的结构简式:CH2CH2
B. 葡萄糖的结构式:C6H12O6
C. Ca2+的结构示意图:
D. NH4Cl的电子式: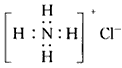
参考答案:C
本题解析:
本题难度:简单
5、选择题 短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为32,且原子最外层电子数之和为10;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素.下列叙述正确的是( )
A..四种元素的原子半径:A<B<C<D
B.最高价氧化物对应的水化物的酸性:B>D
C.C元素处于元素周期表中第3周期第ⅡA族
D.C的最高价氧化物对应的水化物是强酸
参考答案:A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素,B的次外层电子数为8,所以A、C的最外层电子数均为4,短周期元素A、B、C、D的原子序数依次递增,所以A为C,C为Si;原子最外层电子数之和为10,所以10-4-42=1,即B、D均为第ⅠA族元素,所以B为Na,它们的原子序数之和为32,32-6-14-11=1,所以D为H,不符合题意;
则B的次外层电子数应为2,A、C均为第ⅠA族元素,且原子最外层电子数之和为10,所以10-1-12=4,所以B、D均为第ⅣA族元素,原子序数依次递增,即B为C,D为Si,A为H,C为Na,
A.电子层越多,半径越大,同周期从左向右原子半径在减小,所以原子半径为C>D>B>A,故A错误;
B.非金属性C>Si,所以最高价氧化物对应的水化物的酸性:B>D,故B正确;
C.C元素为Na元素,处于元素周期表中第3周期第ⅠA族,故C错误;
D.C的最高价氧化物对应的水化物为NaOH,为强碱,故D错误;
故选B.
本题解析:
本题难度:一般