1、填空题 X、Y、Z、W是中学化学中常见的四种气体.已知:X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收;X是化石燃料燃烧的产物之一,是形成酸雨的物质;Y是一种单质,它的水溶液具有漂白作用;Z是硝酸工业中的有害物质之一,能与水反应;W气体的水溶液滴入酚酞变红色.
请回答下列问题:
(1)X、Y两种气体按物质的量之比1:1在水溶液中能发生反应,其离子方程式为______;
实验室制取W的化学方程式______.
(2)科学家发现,Z在催化剂条件下能与W反应,反应产物中的单质应是______(填化学式);该反应是氧化还原反应,则其中的氧化剂是______(填化学式).
(3)在Z与水的反应中,氧化剂与还原剂的物质的量之比为______.
(4)检验W气体的方法是______.
参考答案:X、Y、Z、W是中学化学中常见的四种气体,X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收;X是化石燃料燃烧的产物之一,是形成酸雨的物质,则X是二氧化硫;Y是一种单质,它的水溶液具有漂白作用,则Y是氯气;Z是硝酸工业中的有害物质之一,能与水反应,则Z是二氧化氮;W气体的水溶液滴入酚酞变红色,说明W气体为碱性气体,则为氨气,
(1)氯气具有强氧化性,二氧化硫具有强氧化性,二者在水溶液里能发生氧化还原反应生成氯化氢和硫酸,离子反应方程式为:Cl2+SO2+2H2O=4H++2Cl-+SO42-,在加热条件下,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,反应方程式为:Ca(OH)2+2NH4Cl△.CaCl2+2NH3↑+2H2O,
故答案为:Cl2+SO2+2H2O=4H++2Cl-+SO42-;Ca(OH)2+2NH4Cl△.CaCl2+2NH3↑+2H2O;
(2)二氧化氮和氨气在一定条件下反应生成单质,根据元素守恒知,生成的单质为N2,该反应中二氧化氮得电子发生还原反应,则NO2作氧化剂,
故答案为:N2;NO2;
(3)二氧化氮和水反应方程式为:3NO2+H2O=2HNO3+NO,该反应中有23的二氧化氮作还原剂,有13的二氧化氮作氧化剂,所以氧化剂和还原剂的物质的量之比为1:2,故答案为:1:2;
(4)氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而使其溶液呈碱性,所以氨气能使湿润的红色石蕊试纸变蓝色,则可以用湿润的红色石蕊试纸检验氨气,如果试纸变蓝色说明该气体是氨气,
故答案为:将湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,证明该气体为NH3.
本题解析:
本题难度:一般
2、选择题 关于氢键,下列说法正确的是
A.每一个水分子内含有两个氢键
B.冰和水中都存在氢键
C.DNA双螺旋的两个螺旋链不是通过氢键相互结合的
D.H2O是一种非常稳定的化合物,这是由于氢键所致
参考答案:B
本题解析:水分子内不存在氢键,A不正确;DNA双螺旋的两个螺旋链是通过氢键相互结合的,C不正确;水分子的稳定性和化学键有关系,与氢键无关,D不正确,答案选B。
点评:该题是基础性试题的考查,也是高考中的常见考点之一。试题主要是考查学生对氢键概念的了解掌握程度,以及灵活运用氢键解决实际问题的能力,难度不大。该题有利于培养学生的逻辑思维能力和发散思维能力。
本题难度:一般
3、填空题 (12分)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是_______________;
(2)Q的具有相同化合价且可以相互转变的氧化物是_________;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 _________________;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)________________,其原因是____________________;
②电子总数相同的氢化物的化学式和立体结构分别是_________________________.;
(5)W和Q所形成的结 构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是?________
构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是?________
参考答案:(1)原子晶体。(2)NO2和N2O4(3)As2S5。(4)①NH3> AsH3 > PH3,因为前者中含有氢键,后两者构型相同,分子间作用力不同;②电子数相同的有SiH4、PH3和H2S结构分别为正四面体,三角锥和V形。(5)SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4 = 8NH3 + Si3N4
本题解析:略
本题难度:一般
4、填空题 (13分)试根据上表填空:
A
| ?
| ?
|
?
| B
| ?
| ?
| C
| D
| E
| F
| ?
|
G
| H
| I
| J
| ?
| L
| K
| M
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| N
| ?
| ?
| Q
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
| | | | | | | | | | | | | | | | | |
|
(1)请写出元素Q的基态原子电子排布式?;元素N在周期表中的位置?周期?族。
(2)基态D原子核外有?个未成对电子;D2分子中分别有?个,?个π键。
(3)化合物DA5中既含离子键,又含共价键和配位键,请写出它的电子式??。
(4)表四中的元素能形成XY2型的共价分子有CE2、CL2、BK2、LE2四种,其分子的空间构型中有一种与其他三种不同,它是?(填化学式);而形成XY3型的共价分子也有四种,它们分别是DA3、DF3、DK3、LE3,其分子的空间构型中也有一种与其他三种不同,它是?(填化学式),它是由_?键(填“极性”或“非极性”,下同)构成的?分子。
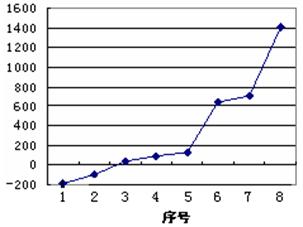
(5)第三周期8种元素按单质熔点高低的顺序如右图所示,其中序号“8”所代表的元素是?(填元素符号);其中气态氢化物稳定性最强的元素是?(填下图中的序号)。
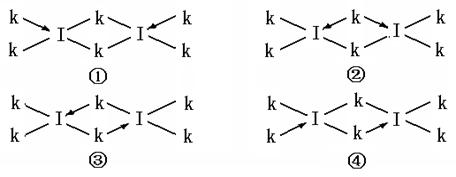
(6)科学家证实,IK3属于共价化合物,分子式为I2K6,其结构式为下列四种中的一种,你认为正确的结构式是____________。
(7)向Q的硫酸盐溶液中加入足量的DA3的水溶液过程中,请写出发生反应的离子方程式?;最后生成配离子的结构式为?。
参考答案:(1)(2分)1s22s22p63s23p63d104s1;?(2分)第4周期? VIII族。
(2)(3分) 3;?1?,? 2。(3)(2分)?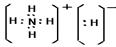 。
。
(4)(4分)? SO2;? SO3?;?极性;?非极性
(5)(2分) Si 、 2 ;(6)(2分) ③ 。
(7)(6分)Cu2++2NH3?H2O= Cu(OH)2↓+2NH4+?
Cu(OH)2 +4NH3 =〔Cu(NH3)4〕2+? + 2OH-。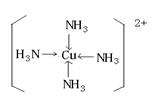
本题解析:(1)Q是铜,根据构造原理可知,电子排布式为1s22s22p63s23p63d104s1。N是铁元素,位于第4周期VIII族。
(2)D是氮元素,最外层有3个未成对电子。氮气是由三键构成的,而三键是由2个π键和1个σ键构成。
(3)化合物DA5是氢化铵,属于离子化合物。电子式为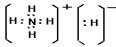 。
。
(4)CE2、CL2、BK2、LE2四种物质分别是CO2、CS2、BeCl2、SO2,其中前三个是直线型化合物,SO2是V形结构。DA3、DF3、DK3、LE3四种物质分别是NH3、NF3、NF3、SO3。其中SO3是平面三角形,是由极性键形成的非极性分子,其余都是三角锥形。
(5)硅是原子晶体,熔点最高。氯元素的非金属性最强,氯化氢最稳定。单质氯的沸点之比Ar的高,是由是2。
(6)氯元素最外层含有孤对电子,能和铝元素形成配位键,所以正确的答案是③。来源:91考试网 91ExaM.org
(7)硫酸铜和氨水发生复分解反应,生成氢氧化铜沉淀。当氨水过量时,由于氨气能和铜离子形成配位键,所以沉淀会溶解,生成配合物。反应式为Cu2++2NH3?H2O= Cu(OH)2↓+2NH4+、Cu(OH)2 +4NH3 =〔Cu(NH3)4〕2+? + 2OH-。
本题难度:一般
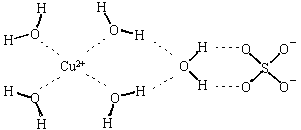
5、填空题 (1)科学家通过X射线推测胆矾结构示意图可简单表示如下,图中虚线表示的作用力分别为?
(2)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。写出此蓝色沉淀溶解的离子方程式:?;
(3)SiCl4与SO42一互为等电子体,预测SO42一的空间构型为??
参考答案:(1)氢键?配位键 (6分)
(2)Cu(OH)2+4NH3·H2O= [Cu(NH3)4]2++2OH-+4H2O(4分)
(3)正四面体?(3分)
本题解析:
(1)氧原子电负性较大,与氢原子间形成氢键,中心原子铜离子有空轨道,氧原子提供孤电子对,Cu2+与O形成配位键。
(2)Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
(3)SiCl4与SO42一互为等电子体,SiCl4中心原子Si,是sp3杂化,空间构型正四面体,等电子体结构相似,预测SO42一的空间构型正四面体。
本题难度:一般