|
高考化学知识点总结《氧化性和还原性强弱的比较》考点强化练习(2019年押题版)(六)
2019-05-30 06:01:46
【 大 中 小】
|
1、选择题 向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,可得到剩余的固体物质。已知:Na2SO3+I2+H2O===Na2SO4+2HI,则剩余固体物质的组成可能是
①NaCl、Na2SO4②NaCl、NaBr、Na2SO4③NaCl、Na2SO4、I2④NaCl、NaI、Na2SO4
A.①②
B.②④
C.①③
D.③④
|
参考答案:A
本题解析:根据题意,物质的还原性顺序是Na2SO3>NaI>NaBr,通入一定量的氯气时,若三种物质完全反应,则剩余NaCl、Na2SO4;若氯气只与前二者反应,则剩余NaCl、NaBr、Na2SO4;若氯气只与亚硫酸钠反应,则剩余物质是NaCl、NaBr、Na2SO4、NaI,因为碘易挥发,所以剩余物质中不可能有碘单质,同时不可能氧化NaBr而NaI有剩余,所以可能剩余的固体成分是①②,答案选A。
考点:考查氯气与物质之间的反应,物质还原性的判断
本题难度:一般
2、选择题 下述实验不能达到预期目的的是
选项
| 实验目的
| 实验方案
| A
| 验证Ksp(AgCl)>Ksp(AgI)
| 向NaCl溶液中滴加少量AgNO3溶液,产生白色沉淀,再滴加KI溶液,可观察到白色沉淀转化为黄色沉淀
| B
| 检验Fe(NO3)2晶体是否已氧化变质
| 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红
| C
| 验证Br2的氧化性强于I2
| 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色
| D
| 比较确定铜和镁的金属活动性强弱
| 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液
|
参考答案:B
本题解析:A、氯化银白色沉淀逐渐转化为AgI黄色沉淀,说明碘化银比氯化银更难溶,则Ksp(AgCl)>Ksp(AgI),正确;B、硝酸亚铁溶液稀硫酸中,则溶液中相当于存在硝酸,硝酸具有强氧化性,氧化亚铁离子为铁离子,再加入KSCN溶液,则溶液变红色,不能证明原固体是否变质,错误;C、溴若与KI溶液发生置换反应,生成的碘单质在四氯化碳中呈紫红色,可以证明溴的氧化性大于碘,正确;D、用石墨电解硝酸镁和硝酸铜的混合液,若铜离子先放电析出,证明铜离子的氧化性大于镁离子,也即Cu的还原性比Mg弱,正确,答案选B。
考点:考查对实验方案的评价
本题难度:一般
3、实验题 (8分)为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
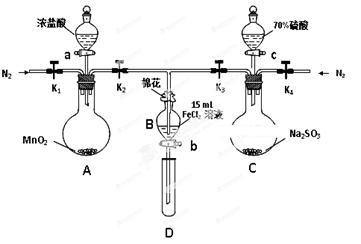
实验过程:
I. 打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ. 打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ. 当B中溶液变黄时,停止加热,关闭K2。
Ⅳ. 打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ. 打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ. 更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是 。
(2)棉花中浸润的溶液为 。
(3)A中发生反应的化学方程式 。
(4)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为 。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”)。
| 过程ⅣB溶液中含有的离子
| 过程ⅥB溶液中含有的离子
| 甲
| 有Fe3+无Fe2+
| 有SO42-
| 乙
| 既有Fe3+又有Fe2+
| 有SO42-
| 丙
| 有Fe3+无Fe2+
| 有Fe2+
|
参考答案:(1)排除装置中的空气,防止干扰 (1分) (2)NaOH溶液 (1分)
(3)MnO2+4HCl(浓 MnCl2+Cl2↑+2H2O (2分) MnCl2+Cl2↑+2H2O (2分)
(4)2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+ (2分)(5)乙、丙 (2分)
本题解析:(1)过程Ⅰ的目的是使装置充满氮气,排除装置中的空气,防止干扰;(2)浓盐酸与MnO2发生反应产生氯气,氯气、HCl都是大气污染物,为了防止污染环境,应该用与它们都能发生反应的碱性溶液,所以棉花中浸润的溶液为NaOH溶液;(3)在A中发生反应制取氯气的化学方程式是MnO2+4HCl(浓 MnCl2+Cl2↑+2H2O;(4)在C中硫酸与Na2SO3发生反应产生SO2, SO2有还原性,会把KMnO4还原为Mn2+,若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,根据电子守恒可得其离子方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;(5)在B中是FeCl2溶液,向其中通入Cl2,若发生反应:2FeCl2+Cl2="2" FeCl3;在溶液中含有Fe3+;若Fe3+> SO2;则向B中通入SO2时会发生反应2Fe3++ SO2+2H2O=2Fe2++SO42-+4H+;在溶液中应该含有SO42-;在过程Ⅵ B溶液中含有的SO42-离子;所以只要过程Ⅳ B溶液中含有的Fe3+离子,在过程Ⅵ B溶液中含有的SO42-离子,就可以证明氧化性:Cl2 > Fe3+ > SO2,所以实验是乙、丙。 MnCl2+Cl2↑+2H2O;(4)在C中硫酸与Na2SO3发生反应产生SO2, SO2有还原性,会把KMnO4还原为Mn2+,若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,根据电子守恒可得其离子方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;(5)在B中是FeCl2溶液,向其中通入Cl2,若发生反应:2FeCl2+Cl2="2" FeCl3;在溶液中含有Fe3+;若Fe3+> SO2;则向B中通入SO2时会发生反应2Fe3++ SO2+2H2O=2Fe2++SO42-+4H+;在溶液中应该含有SO42-;在过程Ⅵ B溶液中含有的SO42-离子;所以只要过程Ⅳ B溶液中含有的Fe3+离子,在过程Ⅵ B溶液中含有的SO42-离子,就可以证明氧化性:Cl2 > Fe3+ > SO2,所以实验是乙、丙。
考点:考查Cl2 、 Fe3+、 SO2氧化性强弱比较的验证方法、操作的知识。
本题难度:一般
4、选择题 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3+ +2H2O
2Fe3+ +H2O2 =2Fe2+ +O2↑+2H+ 下列说法正确的是
[? ]
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
参考答案:CD
本题解析:
本题难度:一般
5、选择题 对于反应O3+I—+H+——I2+O2+H2O(未配平),下列说法正确的是(?)
A.O2和H2O是还原产物
B.该反应能说明O3氧化性大于I2
C.氧化产物与还原物的物质的量之比是1:1

D.配平后的化学方程式为:2O3+2I—+4H+I2+2O2+2H2O
参考答案:BC
本题解析:略
本题难度:简单
|