1、选择题 化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH= 2Fe(OH)3 + 2KI; 3I2 + 6KOH=" 5KI" + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:
4NaClO  ?3NaCl + NaClO4;NaClO4
?3NaCl + NaClO4;NaClO4 ?NaCl + 2O2↑
?NaCl + 2O2↑
下列说法不正确是:
A.氧化性(酸性溶液):FeCl3>Co(OH)3>I2
B.还原性(碱性溶液):Fe(OH)2>I2>KIO3
C.热稳定性:NaCl>NaClO4>NaClO
D.酸性(水溶液):HSCN>H2CO3>HCN
2、填空题 21在Fe + 2HCl ="=" FeCl2(氯化亚铁) + H2↑ 反应中。
② 此反应若转移了12mol的电子,则生成氢气 L(标准状况下).
3、选择题 高铁酸钠(Na2FeO4)是一种新型净水剂,可以对饮用水进行消毒和净化。工业上常通过如下方法制取:3NaNO3+Fe2O3+4NaOH=2Na2FeO4+3NaNO2+2H2O,下列有关说法正确的是
[? ]
A.Fe2O3是氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.生成1mol Na2FeO4时,有3mol电子转移
D.Na2FeO4能杀菌消毒是利用Na2FeO4中+6价铁的强氧化性被还原为Fe3+,净水是利用Fe3+
4、选择题 已知:还原性HSO3->I-,氧化性IO3->?I2。在含 0.3?mol?NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是
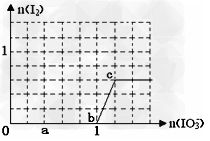
[? ]
A.0~b间的反应可用如下离子方程式表示:3HSO3-?+?IO3-=3SO42-?+?I-?+?3H+
B.a点时消耗NaHSO3的物质的量为0.12?mol
C.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
D.当溶液中I-与I2的物质的量之比为5∶2时,加入的KIO3为0.18mol
5、填空题 (1)某学生用KMnO4制备氯气,反应方程式如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑?+ 8H2O?
当有15.8g KMnO4参加反应时,消耗?molHCl,其中被氧化的HCl有??mol,有?mol电子转移,标准状况下生成Cl 2的体积为?L。
(2)生成的氯气缓慢通入KI-淀粉溶液中,出现蓝色,离子方程式为?,若氯气用量(物质的量)达到KI的3倍时,蓝色完全消失,已知此时生成物中含碘物质只有一种,那么该物质中碘的化合价为?。