1、选择题 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示,下列说法正确的是
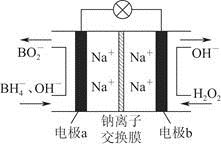
A.电池放电时,Na+从b极区移向a极区
B.电极a采用MnO2,放电时它被还原
C.该电池负极的电极反应式为BH+8OH--8e-=BO+6H2O
D.放电时,a极区溶液的pH升高,b极区溶液pH降低
参考答案:C
本题解析:由图可知,a电极为负极,发生氧化反应,反应物为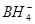 和OH-,生成物为
和OH-,生成物为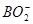 ,电极反应为
,电极反应为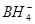 +8OH--8e-=
+8OH--8e-=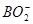 +6H2O,b电极为正极,发生还原反应,反应物为H2O2,生成物为OH-,电极反应为H2O2+2e-=2OH-,B项错误,C项正确;电池放电时,电解质溶液中的阳离子向负极方向移动,A项错误;电池放电时,由电极反应式可知,a极区c(OH-)降低,pH降低,b极区c(OH-)升高,pH升高,D项错误。
+6H2O,b电极为正极,发生还原反应,反应物为H2O2,生成物为OH-,电极反应为H2O2+2e-=2OH-,B项错误,C项正确;电池放电时,电解质溶液中的阳离子向负极方向移动,A项错误;电池放电时,由电极反应式可知,a极区c(OH-)降低,pH降低,b极区c(OH-)升高,pH升高,D项错误。
本题难度:简单
2、选择题 锂离子电池已经成为应用最广泛的可充电电池。某种锂离子电池的结构示意图如下图所示,其中两极区间的隔膜只允许Li+通过。电池充电时的总反应方程式为:LiCoO2==Li1-xCoO2+xLi。关于该电池的推论错误的是( )

A.放电时,Li+主要从负极区通过隔膜移向正极区
B.放电时,负极反应为xLi-xe-===xLi+
C.电解质溶液不能是水溶液
D.充电时,负极(C)上锂元素被氧化
参考答案:D
本题解析:因为电池充电是LiCoO2==Li1-xCoO2+xLi,故放电是Li1-xCoO2+xLi="=" LiCoO2,Li是电池负极,放电时Li-e-===Li+,生成的Li+向正极区移动,AB正确;因为Li属于第IA金属,较活泼,与水反应,Li电极不能在水溶液中浸泡,C正确;充电时,负极Li+被还原为Li单质, D错误。
本题难度:一般
3、填空题 海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分
| Na+
| K+
| Ca2+
| Mg2+
| Cl-
| SO42-
| HCO3-
|
含量/mg·L-1
| 9 360
| 83
| 200
| 1 100
| 16 000
| 1 200
| 118
|
?
(1)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。
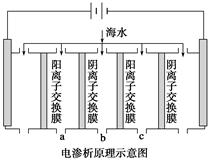
①阴极的电极反应式为__________________。
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式______________________________________。
③淡水的出口为a、b、c中的________出口。
(2)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如下图所示:
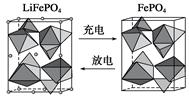
该电池电解质为传导Li+的固体材料。放电时该电极是电池的________极(填“正”或“负”),电极反应式为______________________。
参考答案:(1)①2H2O+2e-=H2↑+2OH-
②Ca2++OH-+HCO3-=CaCO3↓+H2O
③b
(2)正 FePO4+e-+Li+=LiFePO4
本题解析:(1)①电解海水,阴极是H+得电子,而不是活泼金属阳离子,2H2O+2e-=H2↑+2OH-。
②由于在阴极区H+不断放电,破坏水的电离平衡,c(OH-)增大,致使Ca2++OH-+HCO3-=CaCO3↓+H2O。
③因为在阴极区除去Ca2+、Mg2+,所以淡水应b口出。
(2)放电时的电极反应式分别为负极:Li-e-=Li+,
正极:FePO4+Li++e-=LiFePO4。
本题难度:一般
4、选择题 下列关于如图装置的说法错误的是
A.虚线框中若接灵敏电流计,则该装置可将化学能转化为电能
B.虚线框中若接直流电源,则该装置可能发生反应:
Cu+H2SO4===CuSO4+H2↑
C.虚线框中若接直流电源,一段时间后 ,锌棒上可能镀铜
,锌棒上可能镀铜
D.虚线框中无论是接灵敏电流计,还是接直流电源,当生成2.24LH2时一定转移0.2mole-
参考答案:D
本题解析:略
本题难度:一般
5、选择题 下图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
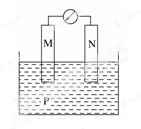
?
| M
| N
| P
|
A
| 锌
| 铜
| 稀硫酸溶液
|
B
| 铜
| 铁
| 稀盐酸溶液
|
C
| 银
| 锌
| 硝酸银溶液
|
D
| 锌
| 铁
| 硝酸铁溶液
参考答案:C
本题解析:该装置没有外接电源,所以是原电池。原电池中,负极材料比正极材料活泼,且负极材料是随着反应的进行质量减少,正极质量增加或放出气泡。根据题意知,N极是负极,M是正极,且N极材料比M极活泼。
选项A中M极材料比N极活泼,故A错误;选项B中M极上质量不增加,溶液中的氢离子在正极放电,故B错误;选项C中N极材料比M极活泼,且M极上有银析出,所以质量增加,符合题意,故C正确;选项D中M极材料比N极活泼,故D错误,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确原电池的工作原理,然后结合题意和装置图灵活运用即可。能根据电极材料的变化判断正负极是解本题的关键。
本题难度:简单
|