1、选择题 有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B为正极;将A、D分别投入等浓度盐酸中,D比A反应剧烈;将铜浸入B的盐溶液里,无明显变化;如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是
[? ]
A.D>C>A>B
B.D>A>B>C
C.D>B>A>C
D.B>A>D>C
2、填空题 (13 分)
(1)CuSO4溶液是中学化学及工农业生产中常见的一种试剂。某同学利用CuSO4溶液,进行以下实验探究。
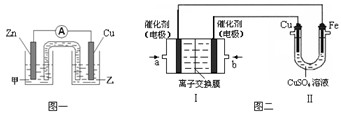
①?图一是根据反应Zn + CuSO4 =" Cu" + ZnSO4设计成的锌铜原电池。电解质甲溶液是?(填“ZnSO4”或“CuSO4”)溶液;Cu极的电极反应式是?。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是?(填“CH4”或“O2”),a处电极上发生的电极反应式是?。
(2)将蓝矾(CuSO4·5H2O)、生石灰和水按一定比例混合,即可得到波尔多液(杀菌剂),其有效成分为难溶的碱式硫酸铜[xCuSO4 ·yCu(OH)2]。为测定某碱式硫酸铜的组成进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀盐酸至恰好完全溶解,另一份高温灼烧后只得到CuO固体。所得数据显示n(HCl)︰n(CuO)=3︰2,则该碱式硫酸铜的化学式中x︰y=?。
(3)E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:
xM(g) Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下?列说法正确的是?
Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下?列说法正确的是?
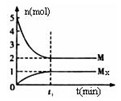
A.该反应的化学方程式是2HF (HF)2
(HF)2
B.平衡时混合气体的平均摩尔质量是33.3
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时, 将增大
将增大
D.M的沸点比同主族下一周期元素的气态氢化物沸点低
3、填空题 (7分)(1)今有氢氧燃料电池,则正极通入的气体是________,负极通入的气体是________,电解质溶液为稀硫酸时,电极反应式为:正极__________ ____负极______ ______ ____,电池的总反应式为
(2)如把H2改为甲烷、KOH作导电物质,则电极反应式为:负极_________ _______
4、简答题 如图,氢氧燃料电池已用于宇宙飞船及潜水艇中,其电极反应为:负极:2H2-4e-+4OH-=4H2O?正极:O2+2H2O+4e-=4OH-所产生的水可作为饮用水,今欲得常温下1L这样的水,则电池内转移电子的物质的量大约是______mol.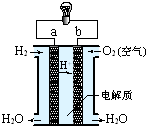
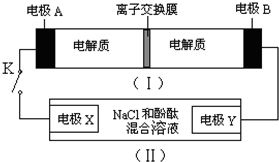
5、选择题 右图装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图.装置(Ⅰ)的离子交换膜只允许Na+?通过.已知电池充、放电的化学反应方程式为2Na2S2+NaBr3
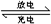
Na2S4+3NaBr.当闭合开关K时,X极附近溶液变红色.下列说法正确的是( )
A.闭合K时,钠离子从右到左通过离子交换膜
B.闭合K时,负极反应为3NaBr-2e-=NaBr3+2Na+
C.闭合K时,X电极的电极反应式为2Cl--2e-=Cl2↑
D.闭合K时,有0.1molNa+通过离子交换膜,X电极上析出标准状况下气体1.12L