1、填空题 (10分)如图所示3套实验装置,分别回答下列问题。

(1)装置1中的Cu是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象。
① 电源的M端为 极
② 乙烧杯中电解反应的离子方程式 。
(3)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理装置3所示。
①请写出A、B两处物质的名称:A___________________B____________________
②请写出电解食盐水的离子方程式__________________________________________
参考答案:(1)负 2Fe3+ + Cu = 2Fe2+ + Cu2+
(2) ①正
②2Cu2+ + 2H2O 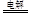 2Cu + O2 ↑ + 4H+
2Cu + O2 ↑ + 4H+
(3) ① A: 饱和NaCl溶液; B :稀NaOH溶液
② 2Cl- + 2H2O 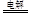 Cl2 ↑+ H2 ↑+ 2OH-
Cl2 ↑+ H2 ↑+ 2OH-
本题解析:⑴装置1为原电池,铜为负极,被氧化,石墨正极,其电池总反应为2Fe3++Cu
本题难度:困难
2、选择题 把a、b、c、d四种金属片浸泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,d为正极;a、c相连时,c上有气泡放出;b、d相连时,电子沿导线由d极流向b极。则这四种金属活动性顺序由大到小为
A.a > b > c > d
B.a > c > d > b
C.c > a > b > d
D.b > d > c > a
参考答案:B
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据a、b相连时,a为负极可知,金属性是a强于b;c、d相连时,d为正极,则金属性是c强于d;a、c相连时,c上有气泡放出,这说明c电极是正极,则金属性是a强于c;b、d相连时,电子沿导线由d极流向b极,说明d电极是负极,所以金属性是d强于b,则这四种金属活动性顺序由大到小为a > c > d > b,答案选B。
点评:该题是基础性试题的考查,难度不大。主要是考查学生对原电池原理的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和知识的迁移能力。
本题难度:一般
3、选择题 下列关于如图装置的说法错误的是

[? ]
A.虚线框中若接灵敏电流计,则该装置可将化学能转化为电能
B.虚线框中若接直流电源,则该装置可能发生反应:Cu+H2SO4===CuSO4+H2↑
C.虚线框中若接直流电源,一段时间后,锌棒上可能镀铜
D.虚线框中无论是接灵敏电流计,还是接直流电源,当生成2.24LH2时一定转移0.2mole-
参考答案:D
本题解析:
本题难度:一般
4、填空题 氢氧燃料电池是符合绿色化学理念的新型发电装置。
下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
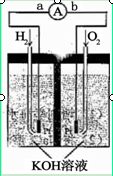
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2 2LiH
2LiH
Ⅱ.LiH+H2O=LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②由LiH与H2O作用,放出的224L(标准状况)H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
参考答案:(1)由化学能转变为电能(1分) 由a到b(1分)
(2)2H2+4OH—-4e-=4H2O或H2+2OH—-2e-=2H2O(2分)
(3)增大电极单位面积吸附H2、O2分子数,加快电极反应速率;或增大电极上H2、O2气体的浓度,加快反应速率。(2分)
(4)①Li(1分) H2O (1分) ②16(2分)
本题解析:
试题解析:(1)氢氧燃料电池是利用了原电池的工作原理,所以是把化学能转化为电能的装置。在装置中,电子的流向是从负极流向正极,图中a为负极,b为正极,所以电子从a流向b。
(2)负极是氢气发生氧化反应,结合电解质溶液,电极反应式为2H2+4OH—-4e-=4H2O或H2+2OH—-2e-=2H2O。
(3)由题目中所述,铂吸附气体的能力强,性质稳定,所以电极表面镀铂粉的目的是增大电极单位面积吸附H2、O2分子数,加快电极反应速率;或者是增大电极上H2、O2气体的浓度,加快反应速率。
(4)①还原剂是指元素化合价升高的物质,在Ⅰ中Li的化合价升高,所以Li是还原剂;氧化剂是指元素化合价降低的物质,在Ⅱ中H2O中氢元素的化合价降低,所以H2O作氧化剂。
②放出的H2的物质的量为10mol,由于能量转化率为80%,实际参加反应的H2的物质的量为10mol×80%=8mol, H2的物质的量为8mol, H2-2e-=2H+则导线上通过的电子的物质的量为8mol×2=16mol。
考点:考查氢氧燃料电池的工作原理、电子流向、相应计算
本题难度:一般
5、选择题 用导线把锌片与铜片连接好,然后平行插入稀硫酸中(如图所示),下列说法正确的是
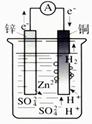
A.铜是负极
B.铜片上无气泡产生
C.锌是负极
D.铜片的质量逐渐减少
参考答案:C
本题解析:略
本题难度:简单