1、推断题 某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如下所示的物质之间的变化:

据此判断:
(1)固体B所含物质的化学式为________。
(2)固体E所含物质的化学式为________。
(3)反应①的离子方程式为____。
参考答案:(1)Al2O3
(2)(NH4)2SO4、K2SO4
(3)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 或 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
本题解析:
本题难度:一般
2、填空题 已知A、B是常见的气体单质且B呈黄绿色,F遇KSCN溶液变血红色,各物质之间的转化关系如右图所示.

(1)写出下列各物质的化学式:D______、E______、G______.
(2)写出反应①的化学方程式:______.
写出F→H的离子方程式______.
(3)描述G→H反应的现象______.
参考答案:已知A、B是常见的气体单质且B呈黄绿色为Cl2,F遇KSCN溶液变血红色,说明F为三价铁离子,依据转化关系可知,H为氢氧化铁,G为氢氧化亚铁,E为亚铁离子的溶液,D为Fe,与C反应生成亚铁离子说明C是AB两种单质生成的酸,A为H2,B为Cl2,C为HCl,D为Fe;E为FeCl2;F为FeCl3;G为Fe(OH)2;H为Fe(OH)3;
(1)DEG的化学式根据上述推断得到:D、Fe;E、FeCl2;G、Fe(OH)2;故答案为:Fe;FeCl2;Fe(OH)2;
(2)反应①是氢气和氯气反应生成氯化氢的反应,化学方程式为:H2+Cl2=2HCl;F→H的反应是三价铁离子沉淀的过程,反应离子方程式为:Fe3++3OH-=Fe(OH)3↓
故答案为:H2+Cl2=2HCl;Fe3++3OH-=Fe(OH)3↓;
(3)G→H反应的现象是氢氧化亚铁氧化为氢氧化铁的反应现象:白色沉淀迅速变成灰绿色,最终变成红褐色;故答案为:白色沉淀迅速变成灰绿色,最终变成红褐色;
本题解析:
本题难度:一般
3、推断题 物质X、Y、Z有如下转化关系
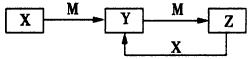
请回答下列问题:
(1)若X、Y、Z均为含铝元素的化合物,M的化学式可以是__________________。
(2)若M是第ⅣA族某元素的最高价氧化物,且M为气体,组成X的阴阳离子均含有10个电子。Y溶液中离子浓度大小顺序为:__________________。
(3)若X是一种黄绿色气体,M是一种常见金属。写出Z→Y的离子方程式:_____________________。
(4)若X、Y、Z中都含有硫元素,已知下列两个热化学方程式:
X转化为Y:2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=-Q1kJ/mol;
X转化为Z:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=- Q2 kJ/mol
请写出X与Z反应转化为Y的热化学方程式:_____________________。
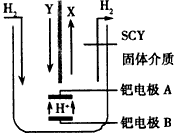
(5)若X、Y、Z中均含有N元素,则在常压下把氢气和用氦气稀释的Y气体,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜作电极,电解可合成X气体(装置如图)。
①则在电解法合成X的电解池中_______(填“能”或“不能”)用水作电解质溶液的溶剂。钯电极A是电解池的______极(填“阳”或“阴”);
②该极上的电极反应式是______________。
参考答案:(1)NaOH或HCl(或其他合理答案)
(2)c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
(3)2Fe2++Cl2=2Fe3++2Cl-
(4)2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-(3Q1- Q2)/2 kJ/mol
(5)①不能;阴;②N2+6e-+6H+=2NH3
本题解析:
本题难度:一般
4、推断题 A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:

(1)A、D的化学式:
A.____________, D.____________。
(2)写出有关反应的化学方程式(是离子反应的直接写离子方程式)
B→C:________________________________________________________________________;
E→B:________________________________________________________________________;
F→C:________________________________________________________________________。
参考答案:(每空2分,共10分)? (1)A.Na D.NaCl (2)2OH-+CO2===CO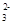 +H2O
+H2O
2Na2O2+2H2O===4Na++4OH-+O2↑?CO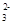 +H2O+CO2===2HCO
+H2O+CO2===2HCO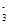
本题解析:E是淡黄色粉末,且A在氧气中点燃生成E,则E应该是过氧化钠。根据反应的条件以及转化特点可判断,A是钠,B是氢氧化钠,C是碳酸钠,D是氯化钠,F是碳酸氢钠。
点评:该题是高考中的常见题型,属于中等难度的试题。该题基础性强,难度不大。主要是考查学生对钠及其化合物性质和转化的熟悉掌握程度,有利于培养学生的逻辑推理能力和规范答题能力,也有助于提高学生的应试能力和学习效率。
本题难度:一般
5、填空题 (14分)已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为——————————————。?
(2)若D是具有氧化性的单质,A属于短周期主族金属单质,则C中阴阳离子个数比为 ------?。
(3)若D是常见过渡金属,欲将反应B+D→C设计成原电池,正极材料可以采用------ ,
正极的电极反应式为 ——————?。
(4)若D是一种常见的温室气体:A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为———?。
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为 ————?。
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为———?。
(7)若A、B、C均能使湿润的pH试纸变红,且相同条件下颜色依次加深,任写一个工业上采用氨水吸收B时,水溶液中发生的氧化还原反应的方程式 —-。?
参考答案:(1) 4NH3+5O2 4NO+6H2O? (2)1:2? (3) 石墨等? Fe3++e-=Fe2+
4NO+6H2O? (2)1:2? (3) 石墨等? Fe3++e-=Fe2+
本题解析:(4)CO32-+CO2+H2O=2HCO3- ?(5)AlO2-?(6)O=C=O? (7)2NH4HSO3+O2=2NH4HSO4等(1)若A能使湿润的红色石蕊试纸变蓝,则A是氨气;C为红棕色气体,则C是NO2。所以D是氧气,B是NO,因此A转化为B反应的化学方程式为4NH3+5O2 4NO+6H2O。
4NO+6H2O。
(2)若D是具有氧化性的单质,A属于短周期主族金属单质,则A是钠,D是氧气,B是氧化钠,C是过氧化钠,所以C中阴阳离子个数比为1︰2。
(3)若D是常见过渡金属,则D是铁,B中含有铁离子,C中含有亚铁离子。所以反应B+D→C设计成原电池,正极材料可以采用石墨等。原电池中正极得到电子,因此电极反应式是Fe3++e-=Fe2+。
(4)若D是一种常见的温室气体,则D是CO2。A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,所以A是氢氧化钠,B是碳酸钠,C是碳酸氢钠。因此B转化为C的离子方程式为CO32-+CO2+H2O=2HCO3- 。
(5)(5)若D为氯碱工业的主要产品,B具有两性,则A是铝盐,B是氢氧化铝,D是氢氧化钠,C是偏铝酸钠。所以C溶液中除氢氧根外还存在的阴离子的化学式为AlO2-。
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则A是金属氧化物,B是CO2,D是碳,C是CO。CO2是含有极性键的共价化合物,结构式是O=C=O。
(7)若A、B、C均能使湿润的pH试纸变红,且相同条件下颜色依次加深,说明相应的酸性依次增强,所以A是硫化氢,B是SO2,C是三氧化硫,D是氧气。由于亚硫酸盐极易被氧化生成硫酸盐,所以反应的方程式可以是2NH4HSO3+O2=2NH4HSO4。
本题难度:一般