1、选择题 甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加沉淀消失,丁滴入甲溶液时,无明显现象发生,据此可以推断丙物质是
A.Al2(SO4)3
B.NaOH
C.BaCl2
D.FeSO4
参考答案:D
本题解析:根据题意,向丁溶液滴入乙溶液,有白色沉淀,继续滴入丁溶液白色沉淀消失,判断丁为NaOH,乙为Al2(SO4)3,因为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,继续加人NaOH,NaOH过量则有Al(OH)3+NaOH=NaAlO2(偏铝酸钠)+2H2O,丁溶液氢氧化钠滴入甲溶液时,无明显现象发生,则可推断甲是BaCl2,因此,丙是FeSO4.
故选D。
点评:本题是一道物质的鉴别题,考查学生物质间的反应知识,可以根据教材知识来回答,难度不大。
本题难度:简单
2、选择题 X、Y、Z是由短周期元素组成的单质,甲、乙是常见的化合物,已知有如下反应:①X + Z→乙;②Y+Z→甲;③X+甲→Y+乙。下列叙述正确的是
A.甲中不含组成X的元素,乙中不含组成Y的元素
B.单质X一定是金属
C.X、Y、Z不可能都是非金属单质
D.如果Y是氢,X是铝,则甲是AlCl3
参考答案:
A
本题解析:略
本题难度:一般
3、简答题 图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中最常见的金属单质,J是气态非金属单质,O是白色沉淀且B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品,其消费量是常被视为一个国家工业发达水平的一种标志(图中部分反应物和生成物没有列出).
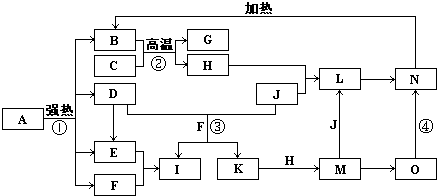
请按要求回答:
(1)写出L的化学式______;
(2)写出:反应③的离子方程式______;反应④的化学方程式______;
(3)反应②在工业生产上的用途是______;
(4)反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为1:1:1:14,则反应①的化学方程式为______.
参考答案:C、H是日常生活中最常见的金属单质,应该为Al和Fe,结合转化关系中,B+C=G+H,可知是铝热反应,C为Al,H为Fe,G是Al2O3,O是白色沉淀且B、H、L、M、N、O中含有同种元素,证明O是Fe(OH)2,N为Fe(OH)3,B为Fe2O3,J是气态非金属单质,能发生反应和铁直接生成L,也可以利用铁和K反应生成的M和J反应生成L,所以L为FeCl3,M为FeCL2,判断K为HCl,依据转化关系中的反应,D+J(Cl2)+F(H2O)=I(H2SO4)+K(HCl),推断D为SO2;I是基础化学工业的重要产品,其消费量是常被视为一个国家工业发达水平的一种标志,证明是I是H2SO4,B、D、E、F、G是氧化物,F、K是氢化物,所以E为SO3,F为H2O;
(1)依据上述推断,L是FeCl3,化学式为FeCl3 ,故答案为:FeCl3;
(2)反应③是二氧化硫和氯气在水溶液中反应的离子方程式:SO2+Cl2+2H2O=4H++SO42-+2Cl-;反应④是氢氧化亚铁被氧化为氢氧化铁,化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-; 4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)反应②是铝热反应,在工业生产上的用途是焊接钢轨(或冶炼钒、铬、锰等金属),故答案为:焊接钢轨;
(4)反应①是分解反应,反应中生成的B(Fe2O3)、D(SO2)、E(SO3)、F(H2O)的物质的量之比为1:1:1:14,依据反应前后原子守恒可以推断出A的化学式,为FeSO4?7H2O,配平化学方程式得到:2(FeSO4?7H2O)?△?.?Fe2O3+SO2↑+SO3↑+14H2O,
故答案为:2(FeSO4?7H2O)?△?.?Fe2O3+SO2↑+SO3↑+14H2O.
本题解析:
本题难度:一般
4、推断题 将A在密闭容器中加热得物质的量相等的B、C、D、E四种气体,若冷却容器到一定温度时,发现有晶体物质X生成,此时原4种气体中只有B没有参加反应,且在相同条件下B相对于氢气的密度为14,是有毒气体。有关物质的转化关系如下图,其中E在常温下为无色液体,G为淡黄色固体,X、F是一种常见的氮肥。反应①中n(C):n(D)=2 :1,反应①②③④在工业生产中均有重要应用,图中部分反应条件及产物未注明。试回答下列问题
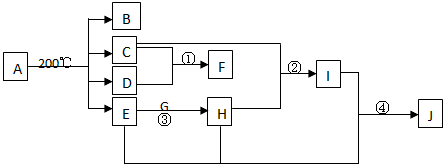
(1)A的化学式__________。 C的电子式__________。D的结构式__________。
(2)写出化学反应方程式②____________________。
(3)写出J的稀溶液与金属铜的离子反应方程式____________________。
参考答案:(1)NH4HC2O4;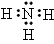 ;
;
(2)4NH3+5O2 4NO+6H2O
4NO+6H2O
(3)3Cu+8H++2NO3-══3Cu2++2NO↑+4H2O
本题解析:
本题难度:一般
5、填空题 (8分)淡黄色固体A和气体X存在如下转化关系:
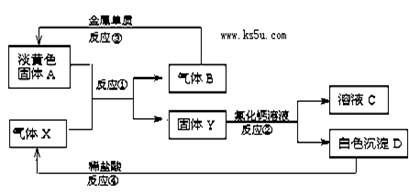
请回答下列问题
(1)反应③的化学方程式为?。
(2)写出反应②④的离子方程式:反应② ?。
反应④ ?。
(4)检验溶液C中的主要阴离子的实验操作为_________? ________。
参考答案:(8分)(1)2Na + O2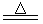 ?Na2O2(2分)?
?Na2O2(2分)?
(2)Ca2++CO32-= CaCO3↓?(2分)? CaCO3 + 2H+=Ca2+ + H2O + CO2↑(2分)
(3)取适量溶液C于一洁净试管中,滴加AgNO3溶液,产生白色沉淀,加入稀HNO3,白色沉淀不消失,证明是Cl-(2分)
本题解析:考查钠及其化合物的性质
在高中化学范畴内,淡黄色固体A和气体X只能为过氧化钠与CO2:2Na2O2+2CO2=2Na2CO3+O2↑,气体B为氧气,而Y为Na2CO3:Na2CO3+CaCl2=CaCO3↓+2NaCl;
白色沉淀D为碳酸钙,可与盐酸生成CO2:CaCO3 + 2H+=Ca2+ + H2O + CO2↑
氧气B与钠可生成过氧化钠:2Na + O2 ?Na2O2
?Na2O2
本题难度:一般